解答题-原理综合题 适中0.65 引用1 组卷167
在水体中部分含氮有机物循环如图1所示.
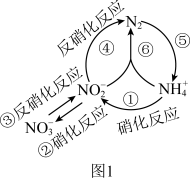

(1)图中属于氮的固定的是____ (填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJ•mol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=____ kJ•mol﹣1
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mg•L﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为____ .
②向三颈烧瓶中通入N2的目的是____ .
③开始反应0~20min,pH快速升高到约6.2,原因之一是___________ ;NO3﹣还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
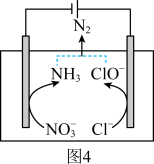
①电解时,阴极的电极反应式为_____ .
②溶液中逸出N2的离子方程式为_____ .


(1)图中属于氮的固定的是
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJ•mol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mg•L﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为
②向三颈烧瓶中通入N2的目的是
③开始反应0~20min,pH快速升高到约6.2,原因之一是
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.

①电解时,阴极的电极反应式为
②溶液中逸出N2的离子方程式为
2019·江苏苏州·模拟预测
类题推荐
将浓度均为0.02mol•L-1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学再室温下对该“碘钟实验”的原理进行探究。
资料:该“碘钟实验”的总反应为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O
+2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
(1)反应A的离子方程式是____ 。对于总反应,I-的作用相当于____ 。
(2)为证明反应A、B的存在,进行实验I。
实验I:a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是____ (试剂不限于一种)
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验II、实验III。(各溶液浓度均为0.02mol•L-1)
溶液从混合时的无色变为蓝色的时间:实验II是15min,实验III是20min。
①实验III中,x、y、z所对应的数值分别是____ 。
②对比试验II、实验III,可得出的实验结论是____ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(各溶液浓度均为0.02mol•L-1)
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式,推测反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:____ 。
资料:该“碘钟实验”的总反应为H2O2+2S2O
(1)反应A的离子方程式是
(2)为证明反应A、B的存在,进行实验I。
实验I:a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验II、实验III。(各溶液浓度均为0.02mol•L-1)
| 用量/mL 实验序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 淀粉-KI溶液 | H2O |
| 实验II | 5 | 4 | 8 | 3 | 0 |
| 实验III | 5 | 2 | x | y | z |
①实验III中,x、y、z所对应的数值分别是
②对比试验II、实验III,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(各溶液浓度均为0.02mol•L-1)
| 用量/mL 实验序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 淀粉-KI溶液 | H2O |
| 实验IV | 4 | 4 | 9 | 3 | 0 |
试结合该“碘钟实验”总反应方程式,推测反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网