解答题-原理综合题 较难0.4 引用1 组卷84
工业合成氨与制备硝酸一般可连续生产,流程如下:
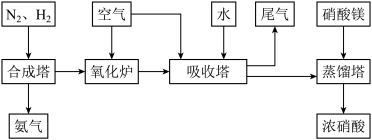
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___ 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=___ 。
(2)合成塔中发生反应为:N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___ 573K(填“>”、“<”或“=”)。
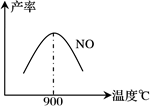
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因
4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___ 。

(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___ 。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___ 。

(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=
(2)合成塔中发生反应为:N2(g)+3H2(g)
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2

(4)吸收塔中反应为:3NO2+H2O
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
19-20高二上·黑龙江大庆·期中
类题推荐
在工业上,合成氨与制备硝酸一般可连续生产,流程如下:
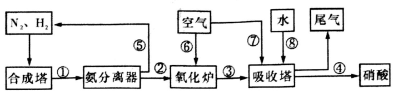
(1)合成塔中发生反应N2(g)+3H2(g) 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___________ 300℃(填“>”、“<”或“=”)。

(2)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气—氧气燃料电池,电解质溶液为KOH,则负极电极发生反应的电极反应式为___________________ 。
(3)在80℃时,将铜与浓硝酸反应得到的0.40mol N2O4气体充入2L已经抽空的固定的密闭容器中发生反应N2O4 (g) 2NO2(g),△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:

①计算a=_________ ,此温度时该反应的平衡常数K=____________ ;
②改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有___________ (填序号)。
(4)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮的氧化物还原为氮气和水,反应机理为:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H=﹣574kJ•mol﹣1
4NO(g)+CO2(g)+2H2O(g) △H=﹣574kJ•mol﹣1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H=﹣1160kJ•mol﹣1
2N2(g)+CO2(g)+2H2O(g) △H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为:____________________ .

(1)合成塔中发生反应N2(g)+3H2(g)
 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
(2)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气—氧气燃料电池,电解质溶液为KOH,则负极电极发生反应的电极反应式为
(3)在80℃时,将铜与浓硝酸反应得到的0.40mol N2O4气体充入2L已经抽空的固定的密闭容器中发生反应N2O4 (g)
 2NO2(g),△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g),△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
①计算a=
②改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有
| A.增大N2O4的起始浓度 | B.升高温度 | C.使用高效催化剂 | D.向混合气体中通入稀有气体 |
(4)硝酸厂的尾气直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮的氧化物还原为氮气和水,反应机理为:CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) △H=﹣574kJ•mol﹣1
4NO(g)+CO2(g)+2H2O(g) △H=﹣574kJ•mol﹣1CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) △H=﹣1160kJ•mol﹣1
2N2(g)+CO2(g)+2H2O(g) △H=﹣1160kJ•mol﹣1则甲烷直接将NO2还原为N2的热化学方程式为:
Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=
CO2+H2。T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___________ (填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g),ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___________ 。
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
(3)容器I中的反应达到平衡时所需的时间___________ (填“大于”“小于”或等于)容器II中的。
(4)a=___________
(5)下列说法中能说明该反应达到平衡状态的是___________。(填字母)
(6)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g) ΔH=-mkJ·mol-1
CH3OH(g) ΔH=-mkJ·mol-1
反应②:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-nkJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-nkJ·mol-1
则下列m与n的关系中,正确的是___________(填字母)。
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g),ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| II | 387 | 0.40 | a | b |
| III | 207 | 0.20 | 0.090 | 0.090 |
(4)a=
(5)下列说法中能说明该反应达到平衡状态的是___________。(填字母)
| A.容器中压强不变 |
| B.混合气体中c(CH3OCH3)不变 |
| C.混合气体的密度不变 |
| D.单位时间内生成1molCH3OCH3同时消耗2molCH3OH |
反应①:CO(g)+2H2(g)
反应②:2CO(g)+4H2(g)
则下列m与n的关系中,正确的是___________(填字母)。
| A.n>2m | B.m>2n | C.2m>n | D.m>3n |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CO2+H2
CO2+H2