填空题 较难0.4 引用2 组卷180
二氧化硫的催化氧化反应:2SO2(g)+O2(g) 2SO3(g)是工业制硫酸重要反应。
2SO3(g)是工业制硫酸重要反应。
(1)从平衡角度分析采用过量O2的原因是_____ 。
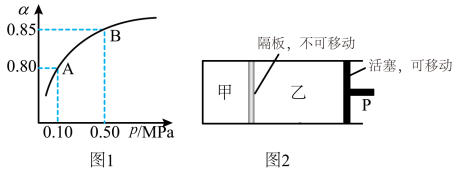
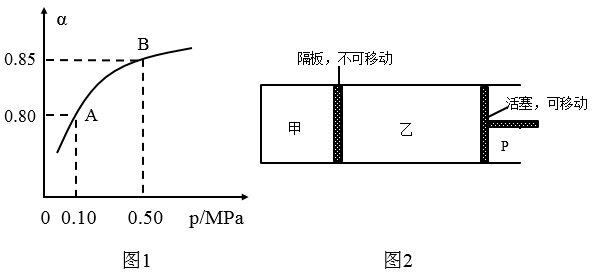
(2)某温度下,SO2的平衡转化率( )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)____ K(B)(填“>”、“<”或“=”,下同)。
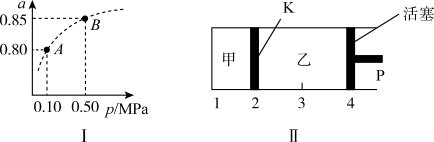
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为 甲
甲_____  乙。
乙。
(4)工业制硫酸的尾气中有少量SO2气体,可用NaClO2碱性溶液吸收,该反应的离子方程式为:___
(1)从平衡角度分析采用过量O2的原因是
(2)某温度下,SO2的平衡转化率(

(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为
(4)工业制硫酸的尾气中有少量SO2气体,可用NaClO2碱性溶液吸收,该反应的离子方程式为:
19-20高二上·江西赣州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。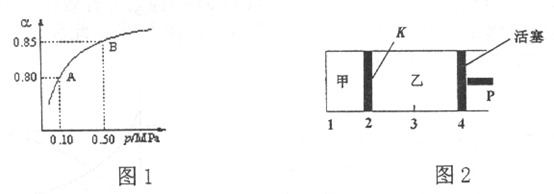
 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1

