填空题 适中0.65 引用2 组卷91
T ℃下,向一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO浓度如下表:
(1)则c2合理的数值为________ (填字母)。
a.4.20 b.4.00 c.2.95 d.2.80
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
若a=2,b=1,则c=______ ,达到平衡时实验组Ⅱ中H2O(g)和实验组Ⅲ中CO的转化率的关系为αⅡ(H2O)________ (填“<”“>”或“=”)αⅢ(CO)。
(3)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图所示。
的变化曲线如图所示。
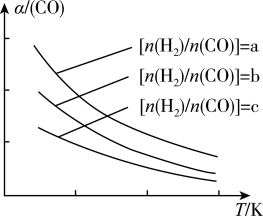
①a、b、c按从大到小的顺序排序为__________________________________________ 。
②根据图像可以判断该反应为放热反应,理由是_______________________________ 。
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol·L-1 | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol·L-1 | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
(1)则c2合理的数值为
a.4.20 b.4.00 c.2.95 d.2.80
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/ mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
若a=2,b=1,则c=
(3)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为2CO(g)+4H2(g)

①a、b、c按从大到小的顺序排序为
②根据图像可以判断该反应为放热反应,理由是
2019高三上·全国·专题练习
类题推荐
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
已知:2C(s)+O2(g) 2CO(g)△H=﹣221.0kJ•mol-1
2CO(g)△H=﹣221.0kJ•mol-1
C(s)+O2(g) CO2(g)△H=﹣393.5kJ•mol-1
CO2(g)△H=﹣393.5kJ•mol-1
则N2(g)+O2(g)=2NO(g) △H =__________ kJ•mol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
则c2合理的数值为_____________ (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
若a=2,b=1,则c=____________ ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O)________________ αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比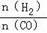 的变化曲线如图1所示。
的变化曲线如图1所示。
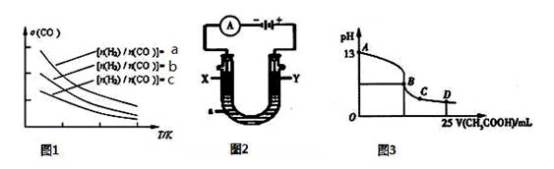
① a、b、c按从大到小的顺序排序为____________ 。
②根据图象可以判断该反应为__________________ 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①负极的电极反应式为__________________ 。
②以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为______________ g。
(1)2NO(g)+2CO(g)
 2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)已知:2C(s)+O2(g)
 2CO(g)△H=﹣221.0kJ•mol-1
2CO(g)△H=﹣221.0kJ•mol-1C(s)+O2(g)
 CO2(g)△H=﹣393.5kJ•mol-1
CO2(g)△H=﹣393.5kJ•mol-1则N2(g)+O2(g)=2NO(g) △H =
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
若a=2,b=1,则c=
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比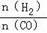 的变化曲线如图1所示。
的变化曲线如图1所示。
① a、b、c按从大到小的顺序排序为
②根据图象可以判断该反应为
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①负极的电极反应式为
②以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=﹣746.5KJ/mol(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5KJ/mol(条件为使用催化剂)
已知:2C(s)+O2(g) 2CO(g)△H=﹣221.0KJ/mol
2CO(g)△H=﹣221.0KJ/mol
C(s)+O2(g) CO2(g)△H=﹣393.5KJ/mol
CO2(g)△H=﹣393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=_____ kJ•mol﹣1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
则C2合理的数值为_____ (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)⇌CO2(g)+H2(g),得到如下三组数据:
若a=2,b=1,则c=_____ ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O)___ αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图1所示。
的变化曲线如图1所示。
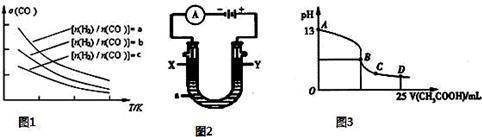
①a、b、c按从大到小的顺序排序为_____ 。
②根据图象可以判断该反应为放热反应,理由是______________ 。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2﹣。
①则负极的电极反应式为_________ 。
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中消耗一氧化碳的质量为_____ g。
(1)2NO(g)+2CO(g)
已知:2C(s)+O2(g)
C(s)+O2(g)
则N2(g)+O2(g)=2NO(g)△H=
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | ||||||
| C(NO)10﹣4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 | ||||||
| C(CO)10﹣3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 | ||||||
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)⇌CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)

①a、b、c按从大到小的顺序排序为
②根据图象可以判断该反应为放热反应,理由是
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2﹣。
①则负极的电极反应式为
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中消耗一氧化碳的质量为
.研究表明: CO2和 CO可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机。
(1)目前工业上有一种方法是用 CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
反应 I: CO2(g)+H2(g) CO(g)+ H2O(g) △H =+41.3kJ·mol -1
CO(g)+ H2O(g) △H =+41.3kJ·mol -1
反 应 II: 2CO(g)+ 4H2(g) C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
①CO2加氢合成乙烯的热化学方程式为_____ 。
②一定条件下的密闭容器中,上述反应 I 达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是_____ (填字母)。
A.减小压强
B 分离出水蒸气.
C.加入适当催化剂
D.增大 H2浓度
E.升高温度
(2)将不同物质的量的H2O(g)和 CO(g)分别通入体积为 2 L 的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
若 a=2,b=1,则 c=_____ ,达到平衡时实验组Ⅱ中 H2O(g)和实验组Ⅲ中 CO的转化率的关系为 αⅡ(H2O)_____ (填“<”“>”或“=”)αⅢ(CO)。
(3)可以用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
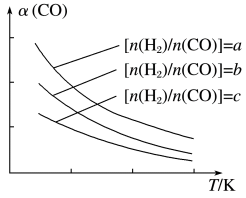
①a、b、c 按从大到小的顺序排序为_____
②根据图象可以判断该反应为放热反应,理由是_________________
(4)工业上还可利用 CO或 CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
据反应①与②可推导出 K1、K2与 K3之间的关系,则 K3=_____ (用 K1、K2表示); 反应③的ΔH_____ (填“>”或“<”)0。
(1)目前工业上有一种方法是用 CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
反应 I: CO2(g)+H2(g)
反 应 II: 2CO(g)+ 4H2(g)
①CO2加氢合成乙烯的热化学方程式为
②一定条件下的密闭容器中,上述反应 I 达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是
A.减小压强
B 分离出水蒸气.
C.加入适当催化剂
D.增大 H2浓度
E.升高温度
(2)将不同物质的量的H2O(g)和 CO(g)分别通入体积为 2 L 的恒容密闭容器中,进行反应:H2O(g)+CO(g)
实验组 | 温度/℃ | 起始量/ mol | 平衡量/ mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO | H2 | |||
| Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
(3)可以用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)

①a、b、c 按从大到小的顺序排序为
②根据图象可以判断该反应为放热反应,理由是
(4)工业上还可利用 CO或 CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2 | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2 | K3 | ||
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


