解答题-原理综合题 适中0.65 引用1 组卷118
环戊二烯(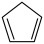 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: (g) =
(g) = 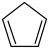 (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应 (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ΔH3=
(g)+2HI(g) ③ΔH3=___________ kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___ ,该反应的平衡常数Kp=____ Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____ (填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
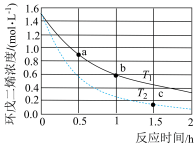
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是____ (填标号)。
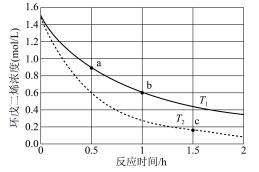
A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L−1
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:
 (g) =
(g) =  (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应 (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ΔH3=
(g)+2HI(g) ③ΔH3=(2)某温度下,等物质的量的碘和环戊烯(
 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是

A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L−1
19-20高三上·辽宁·开学考试
类题推荐
环戊二烯(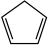 )是重要的有机化工原料,可通过反应
)是重要的有机化工原料,可通过反应 (g)+I2(g)
(g)+I2(g)
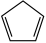 (g)+2HI(g)制得。回答下列问题。
(g)+2HI(g)制得。回答下列问题。
(1)某温度下,在固定容积的密闭容器中发生该反应,该反应达到平衡的标志是_______。
(2)1mol碘和1mol环戊烯(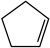 )在10L恒容容器内发生反应。
)在10L恒容容器内发生反应。
①不同温度下环戊烯的物质的量与反应时间的关系如图所示。
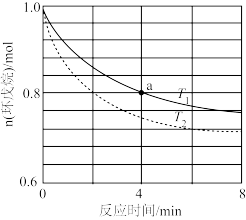
计算a点时,0-4分钟内HI的生成速率v=_______ mol·L-1·min-1。根据上图可得出 的理由是
的理由是_______ 。
②某温度下,若起始压强为 ,平衡时总压强增加了15%,环戊烯的转化率为
,平衡时总压强增加了15%,环戊烯的转化率为_______ ,该反应的平衡常数
_______ (列出计算表达式)。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③欲增加环戊烯的平衡转化率,但K值不变,可采取的措施有_______ (填标号)。
A.通入惰性气体 B.增加碘浓度 C.增加环戊烯浓度 D.提高温度
 )是重要的有机化工原料,可通过反应
)是重要的有机化工原料,可通过反应 (g)+I2(g)
(g)+I2(g) (g)+2HI(g)制得。回答下列问题。
(g)+2HI(g)制得。回答下列问题。(1)某温度下,在固定容积的密闭容器中发生该反应,该反应达到平衡的标志是_______。
| A.容器内总压不变 | B.容器内气体颜色不变 |
| C.容器内气体密度不变 | D.生成1molC=C双键的同时生成2molH-I键 |
 )在10L恒容容器内发生反应。
)在10L恒容容器内发生反应。①不同温度下环戊烯的物质的量与反应时间的关系如图所示。

计算a点时,0-4分钟内HI的生成速率v=
②某温度下,若起始压强为
③欲增加环戊烯的平衡转化率,但K值不变,可采取的措施有
A.通入惰性气体 B.增加碘浓度 C.增加环戊烯浓度 D.提高温度
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
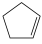 )在刚性容器内发生反应:
)在刚性容器内发生反应: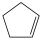 (g)+I2(g)===
(g)+I2(g)=== (g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为
(g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为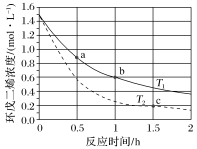
 )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。