解答题-实验探究题 适中0.65 引用3 组卷564
某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
(1)高锰酸钾与草酸反应的离子方程式:______________________________________
(2)由实验I、II可得出的结论是____________________________ 。
(3)关于实验II中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性 KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,______ ,最后加入1mL 0.1mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______ 。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
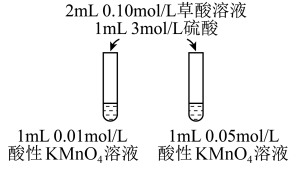
① 他们拟研究的影响因素是______ 。
② 你认为他们的实验方案______ (填“合理”或“不合理”),理由是______ 。
| 编号 | 实验操作 | 实验现象 |
| I | 向一支试管中先加入1mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入1mL 0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅, 30 in后几乎变为无色 |
| II | 向另一支试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1mL 0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
(1)高锰酸钾与草酸反应的离子方程式:
(2)由实验I、II可得出的结论是
(3)关于实验II中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性 KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,
② 若猜想成立,应观察到的实验现象是
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。

① 他们拟研究的影响因素是
② 你认为他们的实验方案
19-20高二上·黑龙江大庆·阶段练习
类题推荐
根据下列实验设计,回答问题:
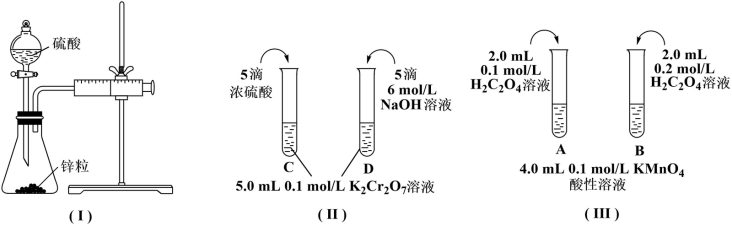
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+推测D试管中实验现象为
(黄色)+2H+推测D试管中实验现象为___ ,用平衡移动原理解释原因:___ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___ ,推测该实验设计___ (填“能”或“不能”)达到实验目的,判断理由是___ 。
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
①由实验ⅰ、实验ⅱ可得出的结论是___ 。
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,___ ,最后加入5mL0.1mol/L草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,
某化学实验小组用酸性 溶液和草酸(
溶液和草酸( )溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下表所示:
)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下表所示:
(1)补全该反应的离子方程式______ : +______+______。
+______+______。
(2)由实验Ⅰ、Ⅱ可得出的结论是______ 。
(3)该小组同学根据经验绘制了 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中 随时间变化的趋势应如图乙所示。
随时间变化的趋势应如图乙所示。

根据图乙所示信息,关于实验Ⅱ中80 s后溶液颜色迅速变浅的现象,该小组同学提出了新的猜想,并继续进行实验探究。
①该小组同学提出的猜想是:______ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
【实验内容及记录】
③若该小组同学提出的猜想成立,则
______ (填“<”“=”或“>”)150 s。
(4)该小组拟采用如图丙所示的实验方案继续探究外界条件对反应速率的影响。

①他们拟研究的影响因素是______ 。
②你认为他们的实验方案______ (填“合理”或“不合理”),理由是______ 。
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入 | 前10 min内溶液颜色无明显变化,之后溶液颜色逐渐变浅,30 min后几乎变为无色 |
II | 向另一支试管中先加入 | 前80 s内溶液颜色无明显变化,之后溶液颜色迅速变浅,约150 s后几乎变为无色 |
(2)由实验Ⅰ、Ⅱ可得出的结论是
(3)该小组同学根据经验绘制了

根据图乙所示信息,关于实验Ⅱ中80 s后溶液颜色迅速变浅的现象,该小组同学提出了新的猜想,并继续进行实验探究。
①该小组同学提出的猜想是:
②请你帮助该小组同学完成实验方案,并填写表中空白。
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量 | 试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 | ||
|
|
| |||
1 | 1 mL | 1 mL | 10滴 | 无 | 150 s |
2 | 1 mL | 1 mL | 10滴 | ||
(4)该小组拟采用如图丙所示的实验方案继续探究外界条件对反应速率的影响。

①他们拟研究的影响因素是
②你认为他们的实验方案
某化学实验小组用酸性 KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
(1)补全高锰酸钾与草酸反应的离子方程式:_____
H2C2O4+ MnO + H+═ Mn2++ +
+ H+═ Mn2++ +
(2)由实验Ⅰ、Ⅱ可得出的结论是_____ 。
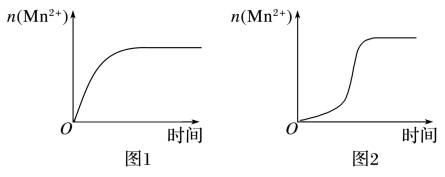
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息对于实验Ⅱ中 80s 后溶液颜色迅速变浅的原因,该小组提出了新的猜想,并继续进行实验探究。
Ⅰ.该小组同学提出的猜想是_____ 。
Ⅱ.请你帮助该小组完成实验方案,并填写表中空白。
【实验内容及记录】(H2C2O4溶液足量)
若该小组同学提出的猜想成立,则 编号2中加入的固体是_____
t___ (“>”“<”“=”) 200s。计算此时实验1中高锰酸钾的的反应速率____ (忽略10滴硫酸的体积)
编号 | 实验操作 | 实验现象 |
Ⅰ | 向一支试管中先加入5 mL 0.01 mol/L 酸性KMnO4溶液,再加入1 滴3 mol/L 硫酸和9 滴蒸馏水,最后加入5 mL 0.1 mol/L草酸溶液 | 前10 min 内溶液紫色无明显变化,后颜色加速变浅,30 min 后几乎变为无色 |
Ⅱ | 向另一支试管中先加入5 mL 0.01 mol/L酸性KMnO4溶液,再加入10 滴3 mol/L硫酸,最后加入5 mL 0.1 mol/L 草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约200 s后几乎变为无色 |
H2C2O4+ MnO
(2)由实验Ⅰ、Ⅱ可得出的结论是

(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息对于实验Ⅱ中 80s 后溶液颜色迅速变浅的原因,该小组提出了新的猜想,并继续进行实验探究。
Ⅰ.该小组同学提出的猜想是
Ⅱ.请你帮助该小组完成实验方案,并填写表中空白。
【实验内容及记录】(H2C2O4溶液足量)
编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 | ||
0.1 mol/L H2C2O4溶液 | 0.01 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
1 | 5.0 | 5.0 | 10 滴 | 无 | 200s |
2 | 5.0 | 5.0 | 10 滴 | 有 | t |
t
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


