解答题-工业流程题 较难0.4 引用1 组卷243
四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2O•Al2O3•4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
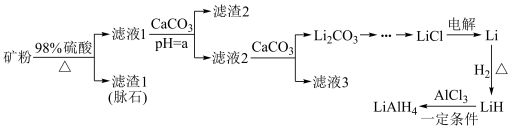
已知:①几种金属氢氧化物沉淀的pH如表所示:
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____ ,“a”的最小值为____ 。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___ ;检验碳酸锂是否洗净的实验操作是___ 。
(3)写出LiH和AlCl3反应的化学方程式:___ (条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___ 。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___ 。(结果保留2位小数)

已知:①几种金属氢氧化物沉淀的pH如表所示:
| 物质 | Fe(OH)3 | A1(OH)3 |
| 开始沉淀的pH | 2.3 | 4.0 |
| 完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是
(3)写出LiH和AlCl3反应的化学方程式:
(4)设计简单方案由Li2CO3制备无水LiCl:
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为
19-20高三上·重庆万州·开学考试
类题推荐
锂辉石是我国重要的锂资源之一,其主要成分为 Li2O、SiO2、Al2O3以及含有少量 Na+、Fe2+、Fe3+、Ca2+、Mg2+等金属离子。工业上用锂辉石制备金属锂的工艺流程如下:
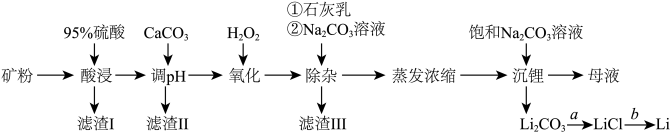
已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有_____ 。
(2)滤渣 I 的主要成分是_____ 。滤渣 II 的主要成分是 Fe(OH)3、Al(OH)3。“氧化” 和“除杂”步骤主要除去的离子有_________ 。
(3) “沉锂”过程中发生反应的离子方程式是_____ 。用热水洗涤 Li2CO3固体,而不用冷水洗涤,其原因是_____ 。
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:_____ 。
(5)工业上实现过程 b 常用的方法是_____ 。
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2的还原能力。LiAlH4的“ 有效氢”为_____ (保留 2 位小数)。

已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Ca(OH)2 | Mg(OH)2 |
| 完全沉淀的pH | 5.2 | 9.6 | 3.2 | 13.1 | 10.9 |
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有
(2)滤渣 I 的主要成分是
(3) “沉锂”过程中发生反应的离子方程式是
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:
(5)工业上实现过程 b 常用的方法是
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2的还原能力。LiAlH4的“ 有效氢”为
四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
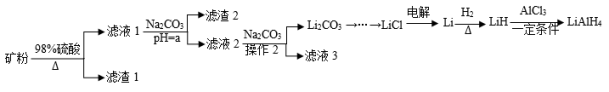
已知:金属氢氧化物沉淀的pH如下表所示:
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__ 。滤渣2的主要成分为__ (填化学式),“a”的最小值为__ 。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__ ,90℃时Ksp(Li2CO3)的值为__ 。
(3)流程中由LiC1制备金属Li的电解条件是__ 。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__ 。
②样品的纯度为__ (列出数学表达式即可)。

已知:金属氢氧化物沉淀的pH如下表所示:
| 物质 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 4 |
| 完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为
②样品的纯度为
铝及其化合物在生产、生活中有重要应用。以某废料(主要成分为Na2SiF6,其他杂质忽略不计)为原料制备冰晶石(Na3AlF6)的一种流程如图所示:

已知:Na2SiF6+4NH3·H2O=2NaF+4NH4F+X↓+2H2O
(1)滤渣X是_________ (写化学式)。
(2)写出“水浴加热”过程中发生反应的化学方程式:_________ 。
(3)制备冰晶石的另一种方法:用氢氧化铝、碳酸钠溶液的混合物吸收HF,放出气体CO2。理论上,反应物Al(OH)3、Na2CO3、HF的物质的量之比为____________ 。
(4)以铝土矿(主要成分为Al2O3,含有杂质Fe2O3、MgO、SiO2)为原料制备NaAlO2、AlCl3。
①参照上述流程,以铝土矿为原料制备NaAlO2溶液。
设计方案流程图:_______ 。(供选试剂:NaOH溶液、稀盐酸、CO2、氨水、铝土矿)
②已知:几种金属氢氧化物沉淀的pH如表所示。
注:pH≥11.2时,Al(OH)3开始溶解。
利用铝土矿制备氯化铝过程中,要用NaOH溶液调节pH,从含Fe3+、Al3+、Mg2+的溶液中分离出Al(OH)3,先调节pH为3.2,过滤;在滤液中加入氢氧化钠溶液,调节pH范围为____ ,过滤、洗涤、干燥得氢氧化铝。 当pH=5时,溶液中c(Al3+)为___ mol·L-1。[已知:常温下,Al(OH)3的Ksp=2.0×10-34]
(5)NaAlH4在有机合成中作还原剂,可由AlCl3和NaH在一定条件下合成。NaAlH4的有效氢为__ 。(用分数表示)(已知:有效氢指1 g含氢还原剂的还原能力相当于多少克H2的还原能力。NaAlH4在氧化还原反应中氢元素的化合价升高至+1)

已知:Na2SiF6+4NH3·H2O=2NaF+4NH4F+X↓+2H2O
(1)滤渣X是
(2)写出“水浴加热”过程中发生反应的化学方程式:
(3)制备冰晶石的另一种方法:用氢氧化铝、碳酸钠溶液的混合物吸收HF,放出气体CO2。理论上,反应物Al(OH)3、Na2CO3、HF的物质的量之比为
(4)以铝土矿(主要成分为Al2O3,含有杂质Fe2O3、MgO、SiO2)为原料制备NaAlO2、AlCl3。
①参照上述流程,以铝土矿为原料制备NaAlO2溶液。
设计方案流程图:
②已知:几种金属氢氧化物沉淀的pH如表所示。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.3 | 3.3 | 9.1 |
| 完全沉淀pH | 3.1 | 4.0 | 11.1 |
利用铝土矿制备氯化铝过程中,要用NaOH溶液调节pH,从含Fe3+、Al3+、Mg2+的溶液中分离出Al(OH)3,先调节pH为3.2,过滤;在滤液中加入氢氧化钠溶液,调节pH范围为
(5)NaAlH4在有机合成中作还原剂,可由AlCl3和NaH在一定条件下合成。NaAlH4的有效氢为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


