解答题-工业流程题 适中0.65 引用1 组卷353
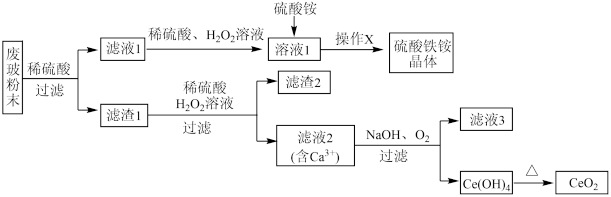
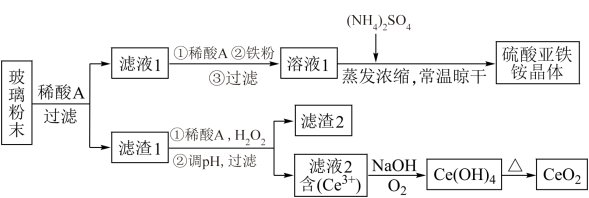
二氧化铈CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末含(SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________ 。
(2)滤液1中加入H2O2溶液的目的是____________________ 。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________ 。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________ 。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________________________________ 。
(5)由滤液2生成Ce(OH)4的离子方程式___________________________ 。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:___________________________ 。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________________ (结果保留两位有效数字)。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是
(2)滤液1中加入H2O2溶液的目的是
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式
(5)由滤液2生成Ce(OH)4的离子方程式
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为
18-19高三·吉林延边·开学考试
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网