解答题-原理综合题 适中0.65 引用2 组卷171
回收利用CO2是环境科学研究的热点课题,是减轻温室效应危害的重要途径。
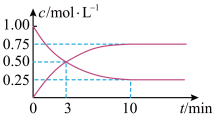
(1)工业上,利用天然气与二氧化碳反应制备合成气(CO和H2),化学方程式为CO2(g)+CH4(g)=2CO(g)+2H2O(g)上述反应的能量变化如图1所示,该反应是________ (填“吸热反应,或“放热反应”)。
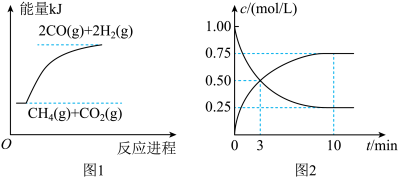
(2)工业上用CO2生产甲醇(CH3OH)燃料,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molO2和4molH2,一定条件下发-反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,用CH3OH表示的平均反应速率为______ 。
②若反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.v(H2)=0.01mol•L-1•s-1 B.v(CO2)=0.15mol•L-1•s-1
C.v(CH3OH)=0.3mol•L-1•min-1 D.v(H2O)=0.45mol•L-1•min-1
该反应进行由快到慢的顺序为______ (填字母)。
③下列描述能说明反应达到最大限度的是_______ (填字母)。
A.混合气体的密度保持不变
B.混合气体中CH3OH的体积分数约为21.4%
C.混合气体的总质量保持不变
D.H2、CH3OH的生成速率之比为3∶1
(3)甲醇(CH3OH)是一种可再生能源,具有广阔的开发和应用前景。以甲醇、氧气和KOH溶液为原料,石墨为电极制造新型手机电池,甲醇在______ 极反应,电极反应式为____________ 。
(1)工业上,利用天然气与二氧化碳反应制备合成气(CO和H2),化学方程式为CO2(g)+CH4(g)=2CO(g)+2H2O(g)上述反应的能量变化如图1所示,该反应是

(2)工业上用CO2生产甲醇(CH3OH)燃料,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molO2和4molH2,一定条件下发-反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,用CH3OH表示的平均反应速率为
②若反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.v(H2)=0.01mol•L-1•s-1 B.v(CO2)=0.15mol•L-1•s-1
C.v(CH3OH)=0.3mol•L-1•min-1 D.v(H2O)=0.45mol•L-1•min-1
该反应进行由快到慢的顺序为
③下列描述能说明反应达到最大限度的是
A.混合气体的密度保持不变
B.混合气体中CH3OH的体积分数约为21.4%
C.混合气体的总质量保持不变
D.H2、CH3OH的生成速率之比为3∶1
(3)甲醇(CH3OH)是一种可再生能源,具有广阔的开发和应用前景。以甲醇、氧气和KOH溶液为原料,石墨为电极制造新型手机电池,甲醇在
18-19高一下·河南·期末
类题推荐
能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)。
根据以上信息可知,1 mol氢气在足量的氯气中燃烧生成氯化氢气体放出热量_____ kJ。
(2)以氢气、空气、KOH溶液为原料,石墨为电极,可构成氢氧燃料电池。该电池的总反应方程式为:2H2+O2=2H2O,则其负极反应式为:___________ 。
(3)工业上有一种方法是用CO2来生产燃料甲醇(化学式:CH3OH,常温下为无色液体),可以将CO2变废为宝。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①从开始到平衡,CH3OH的平均反应速率v(CH3OH)=_______ ;H2的转化率a(H2)=_______ 。
②若反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:
a.v(CO2)=0.15 mol·L-1·min-1 b.v(H2)=0.01 mol·L-1·s-1
c.v(CH3OH)=0.2 mol·L-1·min-1 d.v(H2O)=0.45 mol·L-1·min-1
该反应进行由快到慢的顺序为____________ (填字母)。
③以下结论可以作为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)已达平衡的标志的是__________ 。
a.v(H2)正=v(CH3OH)逆
b.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
c.容器内压强不再变化
d.单位时间内,每生成1 mol CH3OH,同时消耗3 mol H2
(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)。
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
根据以上信息可知,1 mol氢气在足量的氯气中燃烧生成氯化氢气体放出热量
(2)以氢气、空气、KOH溶液为原料,石墨为电极,可构成氢氧燃料电池。该电池的总反应方程式为:2H2+O2=2H2O,则其负极反应式为:
(3)工业上有一种方法是用CO2来生产燃料甲醇(化学式:CH3OH,常温下为无色液体),可以将CO2变废为宝。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①从开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②若反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在四种不同情况下的反应速率分别为:
a.v(CO2)=0.15 mol·L-1·min-1 b.v(H2)=0.01 mol·L-1·s-1
c.v(CH3OH)=0.2 mol·L-1·min-1 d.v(H2O)=0.45 mol·L-1·min-1
该反应进行由快到慢的顺序为
③以下结论可以作为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)已达平衡的标志的是
a.v(H2)正=v(CH3OH)逆
b.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
c.容器内压强不再变化
d.单位时间内,每生成1 mol CH3OH,同时消耗3 mol H2
能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
请根据以上信息可知,1mol氢气在足量的氯气着燃烧生成氯化氢气体放出热量___________ 。
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________ 。
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
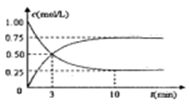
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________ ;H2的转换率α(H2)=___________ 。
②若反应CO2+3H2 CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为___________ (填字母)。
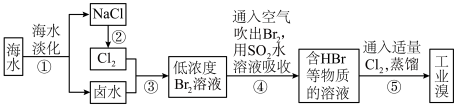
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:

①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑______
②以上五个过程中涉及氧化还原反应的有___________ 个。
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是___________ 。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②若反应CO2+3H2
 CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:

①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑
②以上五个过程中涉及氧化还原反应的有
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网