解答题-实验探究题 适中0.65 引用1 组卷285
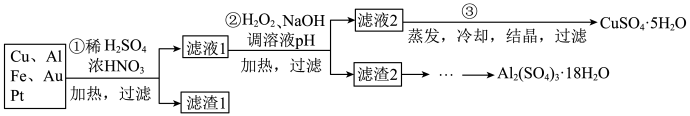
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________ ;得到滤渣1的主要成分为__________ 。
(2)第②步中加H2O2的作用是__________ ,使用H2O2的优点是__________ ;调溶液pH的目的是使__________ 生成沉淀。
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是__________ 。
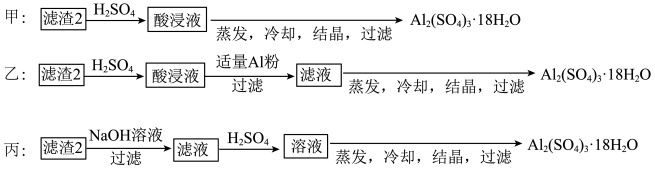
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2 酸浸液
酸浸液 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
乙:滤渣2 酸浸液
酸浸液 滤液
滤液 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
丙:滤渣2 滤液
滤液 溶液
溶液 Al2(SO4)3·18H2O
Al2(SO4)3·18H2O
上述三种方案中,__________ 方案不可行,原因是__________ ;
从原子利用率角度考虑,__________ 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=__________ ;
②下列操作会导致含量的测定结果偏高的是______ 。
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为
(2)第②步中加H2O2的作用是
(3)第③步所得CuSO4·5H2O制备无水CuSO4的方法是
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
甲:滤渣2
乙:滤渣2
丙:滤渣2
上述三种方案中,
从原子利用率角度考虑,
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①写出计算CuSO4·5H2O质量分数的表达式ω=
②下列操作会导致含量的测定结果偏高的是
a 未干燥锥形瓶
b 滴定终点时滴定管尖嘴中产生气泡
c 未除净可与EDTA反应的干扰离子
2019·天津南开·二模
类题推荐
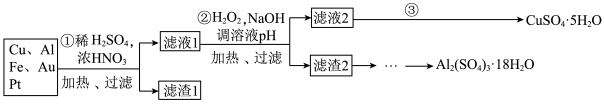
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含 、
、 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

 第
第 步Cu与混酸反应的离子方程式为
步Cu与混酸反应的离子方程式为______  得到滤渣1的主要成分为
得到滤渣1的主要成分为______ 。
 第
第 步中加入
步中加入 的作用是
的作用是______ ,使用 的优点是
的优点是______ ;调溶液pH的目的是______ 。
 简述第
简述第 步由滤液2得到
步由滤液2得到 的方法是
的方法是______ 。
 由滤渣2制取
由滤渣2制取 ,设计了以下三种方案:
,设计了以下三种方案:
甲:滤渣 酸浸液
酸浸液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
乙:滤渣 酸浸液
酸浸液 滤液
滤液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
丙:滤渣2 滤液
滤液 溶液
溶液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
上述三种方案中,______ 方案不可行,原因是______ ;从原子利用率角度考虑,______ 方案更合理。
 用滴定法测定
用滴定法测定 含量.取a g试样配成100mL溶液,每次取
含量.取a g试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式
______ 。

| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法: |
| 方法Ⅲ | 用肼 |
甲:滤渣
乙:滤渣
丙:滤渣2
上述三种方案中,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
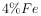 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线: