解答题-实验探究题 0.65 引用2 组卷789
高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。
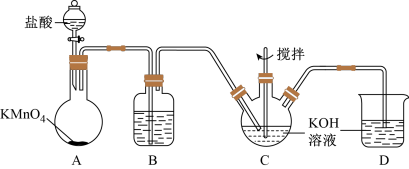
(1)B装置的作用为______________________ ;
(2)反应时需将C装置置于冷水浴中,其原因为__________________ ;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是________ ,制备K2FeO4的离子方程式_________________ ;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称________ ,其反应原理为______________________ (用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______________________ ;
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
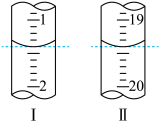
①消耗Na2S2O3标准溶液的体积为____________ mL。
②原样品中高铁酸钾的质量分数为_________________ 。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数____________ (填“偏高”、“偏低”或“无影响”)。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。

(1)B装置的作用为
(2)反应时需将C装置置于冷水浴中,其原因为
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

①消耗Na2S2O3标准溶液的体积为
②原样品中高铁酸钾的质量分数为
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数
2019·天津·二模


