解答题-原理综合题 适中0.65 引用1 组卷175
2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_________________ 。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO
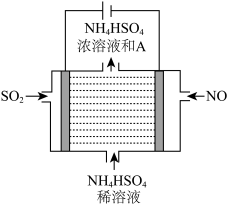
①写出物质A的化学式____________ 。
②NO在电极上发生的反应为_________________ 。
SO2在电极上发生的反应为__________________ 。
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式______________________________________ 。
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为__________________ 。(用物质的量浓度符号由大到小排列)
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH

①写出物质A的化学式
②NO在电极上发生的反应为
SO2在电极上发生的反应为
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为
18-19高二下·湖北省直辖县级单位·期末
类题推荐
氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)2],请写出此反应的热化学方程式:___________ 。
(2)N2O5 在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量 N2O5,测得 N2O5 浓度随时间的变化如下表:
①反应开始时体系压强为 P0,第 2.00min 时体系压强为 P1,则 P1:P0=_________ 。2.00~5.00min 内用 NO2 表示的该反应的平均反应速率为_________ 。
②一定温度下,在恒容密闭容器中充入一定量 N2O5 进行该反应,能判断反应已达到化学平衡状态的是________ (填字母序号)。
a.NO2 和 O2 的浓度比保持不变 b.容器中压强不再变化
c.2v 正(NO2)=v 逆(N2O5) d.气体的平均相对分子质量为 43.2,且保持不变
(3)平衡常数 Kp 是用反应体系中气体物质的分压来表示的,即将K表达式中平衡浓度用平衡分压代替,分压=总压 × 物质的量分数,例如:p(NO2)=p总·x(NO2)(x表示气体的物质的量分数)。
N2O4 与 NO2 转换的热化学方程式为N2O4(g)⇌2NO2(g) △H=+24.4kJ/mol
上述反应中,正反应速率 v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则 Kp 为_________ (以 k 正、k 逆表示)。
(4)下图是密闭反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,合成 NH3 反应达到平衡时,混合物中 NH3 的物质的量分数随压强的变化曲线,已知该反应为放热反应。
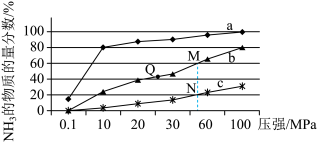
①曲线 a 对应的温度是________ 。
②M 点对应的 H2 的转化率是___________ 。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。通过计算判定(NH4)2SO2 溶液的酸碱性________ 。(写出计算过程,并用简要的文字加以说明)(已知:氨水Kb=1.8×10-5;H2SO3:Ka1=1.3×10-2 Ka2=6.3×10-8)
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)2],请写出此反应的热化学方程式:
(2)N2O5 在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量 N2O5,测得 N2O5 浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为 P0,第 2.00min 时体系压强为 P1,则 P1:P0=
②一定温度下,在恒容密闭容器中充入一定量 N2O5 进行该反应,能判断反应已达到化学平衡状态的是
a.NO2 和 O2 的浓度比保持不变 b.容器中压强不再变化
c.2v 正(NO2)=v 逆(N2O5) d.气体的平均相对分子质量为 43.2,且保持不变
(3)平衡常数 Kp 是用反应体系中气体物质的分压来表示的,即将K表达式中平衡浓度用平衡分压代替,分压=总压 × 物质的量分数,例如:p(NO2)=p总·x(NO2)(x表示气体的物质的量分数)。
N2O4 与 NO2 转换的热化学方程式为N2O4(g)⇌2NO2(g) △H=+24.4kJ/mol
上述反应中,正反应速率 v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则 Kp 为
(4)下图是密闭反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,合成 NH3 反应达到平衡时,混合物中 NH3 的物质的量分数随压强的变化曲线,已知该反应为放热反应。

①曲线 a 对应的温度是
②M 点对应的 H2 的转化率是
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。通过计算判定(NH4)2SO2 溶液的酸碱性
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
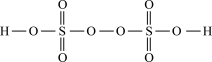 。在工业上用作强氧化剂。
。在工业上用作强氧化剂。



