解答题-原理综合题 较难0.4 引用1 组卷239
Ⅰ.为了探究一种固体化合物甲(仅含3种元素)的组成和性质,设计并完成如下实验:(气体体积已经换算成标准状况下的体积)
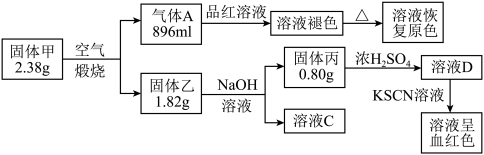
请回答:
(1)写出化合物甲的化学式________ 。
(2)写出形成溶液C的化学方程式:_____________ 。
(3)写出气体A通入溶液D中,发生反应的离子反应方程式__________ 。
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g) CH3CH2OH(g) +H2O(g) △H1
CH3CH2OH(g) +H2O(g) △H1
反应Ⅱ. CH3COOH(g)+H2(g) CO(g)+CH4(g)+H2O(g) △H2>0
CO(g)+CH4(g)+H2O(g) △H2>0
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1___ 0。(填“>”或“<”)
(2)某实验中控制 CH3COOH 和 H2初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有______ 。
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K=_____ 。
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是_________________ 。
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”示意图 。_____


请回答:
(1)写出化合物甲的化学式
(2)写出形成溶液C的化学方程式:
(3)写出气体A通入溶液D中,发生反应的离子反应方程式
Ⅱ.近年来化学家又研究开发出了用 H2和CH3COOH 为原料合成乙醇(反应Ⅰ),同时会发生副反应Ⅱ。
反应Ⅰ.CH3COOH(g)+2H2(g)
反应Ⅱ. CH3COOH(g)+H2(g)
已知:乙醇选择性是转化的乙酸中生成乙醇的百分比。请回答:
(1)反应Ⅰ一定条件下能自发进行,则△H1
(2)某实验中控制 CH3COOH 和 H2初始投料比为 1∶1.5,在相同压强下,经过相同反应时间测得如下实验数据:
| 温度(K) | 催化剂 | 乙酸的转化率(%) | 乙醇选择性(%) |
| 573 | 甲 | 40 | 50 |
| 573 | 乙 | 30 | 60 |
| 673 | 甲 | 55 | 35 |
| 673 | 乙 | 40 | 50 |
①有利于提高CH3COOH转化为CH3 CH2OH平衡转化率的措施有
A 使用催化剂甲 B 使用催化剂乙
C 降低反应温度 D 投料比不变,增加反应物的浓度
E 增大CH3COOH和H2的初始投料比
②673K甲催化剂作用下反应Ⅰ已达平衡状态,测得乙酸的转化率为50%,乙醇的选择性40%,若此时容器体积为 1.0L,CH3COOH 初始加入量为2.0mol,则反应Ⅰ的平衡常数 K=
③表中实验数据表明,在相同温度下不同的催化剂对CH3COOH转化成CH3CH2OH的选择性有显著的影响,其原因是
(3)在图中分别画出I在催化剂甲和催化剂乙两种情况下“反应过程-能量”

18-19高二下·浙江嘉兴·期末
类题推荐
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2 II
CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=___ ;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___ 。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___ 。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图 ___ 。

CO2(g)+3H2(g)
CO2(g)+H2(g)
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”

催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2 II
CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=___ ;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___ 。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___ 。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图 ___ 。

CO2(g)+3H2(g)
CO2(g)+H2(g)
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”

催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CO2(g)+H2(g) CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1。
②H2O(l)=H2O(g) △H3=+44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______ ;反应II的△H2=______ kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________ 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________ 。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________ 。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______ 极,该电极反应式是_________ 。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1 ICO2(g)+H2(g)
 CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1。
②H2O(l)=H2O(g) △H3=+44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


