解答题-实验探究题 适中0.65 引用1 组卷116
印刷电路板在电子行业中应用广泛,其中的铜质线路是通过化学试剂刻蚀覆盖在有机绝缘材料上的铜板形成的。从废弃的印刷电路板上可以回收铜及其化合物。甲、乙、丙三组同学分别采用了不同的回收方案如下(部分产物略去):
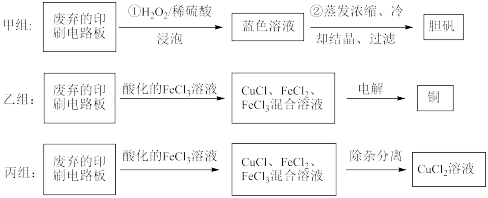
(1)甲组步骤①中反应的离子方程式为:______ 。
(2)甲组同学进行实验时,发现H2O2已变质不能使用,他们需要在不使用H2O2的前提下实现反应Cu+H2SO4=CuSO4+H2↑。在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”,不能实现的装置中不要填写)。
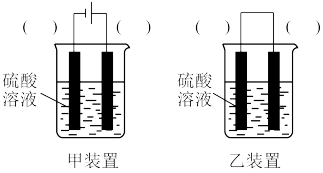
________
(3)乙组同学使用的FeCl3溶液需要酸化的原因是:________ 。
(4)图为乙组电解时的装置图。其中铜电极应该与电源的_____ (填“正极”或“负极”)相连。当观察到阴极有少量气泡产生时,即停止电解,此时要回收的铜已全部析出。则阴极发生的电极反应为(按反应发生的先后顺序书写):_____ 、___ 、___ 。
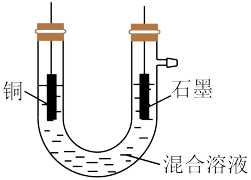
(5)乙组同学用1L 0.2mol/L的FeCl3溶液溶解铜,电解时,阴极产生无色气体0.56L(标准状况下)时停止电解,此时阳极产生的气体在标准状况下的体积共_____ L。
(6)丙组同学利用FeCl3腐蚀铜板后的混合液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤(写出试剂和操作)①_____________ ;②____ ;③过滤弃去滤渣。

(1)甲组步骤①中反应的离子方程式为:
(2)甲组同学进行实验时,发现H2O2已变质不能使用,他们需要在不使用H2O2的前提下实现反应Cu+H2SO4=CuSO4+H2↑。在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”,不能实现的装置中不要填写)。

(3)乙组同学使用的FeCl3溶液需要酸化的原因是:
(4)图为乙组电解时的装置图。其中铜电极应该与电源的

(5)乙组同学用1L 0.2mol/L的FeCl3溶液溶解铜,电解时,阴极产生无色气体0.56L(标准状况下)时停止电解,此时阳极产生的气体在标准状况下的体积共
(6)丙组同学利用FeCl3腐蚀铜板后的混合液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤(写出试剂和操作)①
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2、浓硫酸、NaOH溶液、CuO、Cu | ||
18-19高二下·北京丰台·课时练习
类题推荐
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
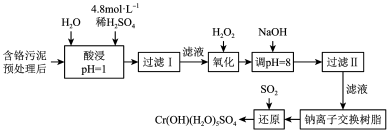
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)酸浸时,为了提高浸取率可采取的措施是___ (写一条即可)。
(2)调pH=8是为了除去___ (填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_ Na2Cr2O7+_ SO2+_ H2O=________ Cr(OH)(H2O)5SO4+_ Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___ 。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___ ;②___ ;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)调pH=8是为了除去
(3)试配平氧化还原反应方程式:
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是___________________________________ (至少写两条)。
(2)H2O2的作用是_____________________________________ 。
(3)调pH=8是为了除去________________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是__________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________ 。
(二)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
(6)①____________________________________ ;②_____________________________________ ;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
(一)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是
(2)H2O2的作用是
(3)调pH=8是为了除去
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是
(5)试配平氧化还原反应方程式:
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为
(二)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
(6)①
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO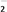 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO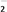 的离子方程式为
的离子方程式为____________________ 。
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是________ (至少写一条)。
(2)H2O2的作用是______________ 。
(3)调pH=8是为了除去__________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+ H2O===
H2O=== Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________ 。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________ ;
②________________________________________________________________________ ;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
(一)染料工业排放的废水中含有大量有毒的NO
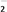 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO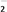 的离子方程式为
的离子方程式为(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)H2O2的作用是
(3)调pH=8是为了除去
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是
(5)试配平氧化还原反应方程式:
 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+ H2O===
H2O=== Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①
②
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


