解答题-结构与性质 适中0.65 引用1 组卷101
原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为____ , Y2X2分子中σ键和π键个数比为_______ 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是_____ 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是_______ 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为______ 。
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于________ (填晶体类型)。
(5)下列有关的说法正确的是________________ 。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2YO3的分子结构中含有一个非羟基氧,故其为中强酸
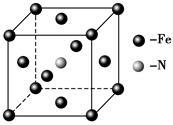
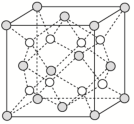
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_____ 。已知该晶胞密度为ρ g/cm3,阿伏加 德罗常数为NA,求晶胞边长a=_____ cm。(用含ρ、NA的计算式表示)
(1)Y2X2分子中Y原子轨道的杂化类型为
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于
(5)下列有关的说法正确的是
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为

18-19高二下·黑龙江哈尔滨·期中
类题推荐
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为_______________ ;
②尿素(H2NCONH2)分子中C原子的杂化方式是_____________ ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______ 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________ (填晶体类型)。
(2)下列说法正确的是_________ (填字母序号)。
(3)O和Na的一种只含有离子键的化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为______ 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a=_______ cm(用含ρ、NA的计算式表示)。

(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为
②尿素(H2NCONH2)分子中C原子的杂化方式是
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(2)下列说法正确的是
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网