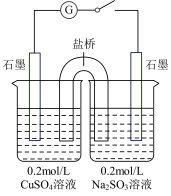
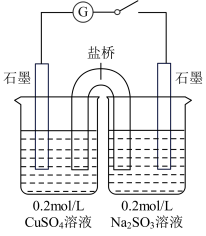
解答题-实验探究题 适中0.65 引用1 组卷82
Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______ 。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:____ Cu2++ ____ SO32-+ ____ =____ Cu2O↓+ ____ + ____ HSO3-
【实验探究】
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______ 。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______ 。
(5)iii中砖红色沉淀消失的原因是_______ 。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______ 。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______ 、_______ 。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:
【实验探究】
| 操作 | 现象 |
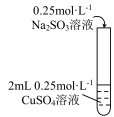 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是
(5)iii中砖红色沉淀消失的原因是
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是
18-19高二下·河北邯郸·阶段练习
类题推荐
某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
(1)制取新制Cu(OH)2悬浊液的离子方程式为_________ 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:_________ 。检验Cu(OH)2洗涤干净的方法是_________ 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3) +Cl- + 2H2O 、
+Cl- + 2H2O 、 _________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:_________ 。
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,__________ ,则说明砖红色沉淀是Cu2O。
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入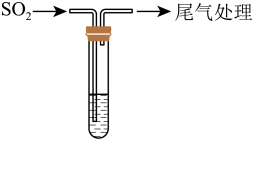 | 实验Ⅰ | 1.5 mL 1 mol·L-1 CuSO4溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ | 1.5 mL 1 mol·L-1 CuCl2溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网