解答题-原理综合题 适中0.65 引用1 组卷298
“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳和硫的化合物的综合利用成为研究的热点。请回答下列问题:
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是_______ (填选项字母)。
A. 有漂白性而
有漂白性而 没有
没有
B.少量 能与
能与 反应生成
反应生成
C. 能使酸性
能使酸性 溶液褪色而
溶液褪色而 不能
不能
D. 溶液显碱性而
溶液显碱性而 溶液显中性
溶液显中性
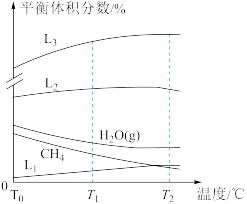
(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为_______ ;两个系统制得等量的H2所需能量较少的是_______ 。
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol ,发生反应2CO(g)+SO2 (g)⇌S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
,发生反应2CO(g)+SO2 (g)⇌S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
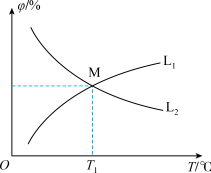
①图中能表示CO的平衡体积分数与温度关系的曲线为_______ (填“L1”或“L2”)。
②T1 ℃时, 的平衡转化率α1=
的平衡转化率α1=_______ ,反应的平衡常数
_______ 。
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是_______ (填选项字母)。
A.增大压强 B.充入一定量 C. 充入一定量
C. 充入一定量 D.加入适当催化剂
D.加入适当催化剂
④向起始温度为 ℃的10 L绝热容器中充入2 mol CO和1 mol
℃的10 L绝热容器中充入2 mol CO和1 mol  ,重复实验,该反应的平衡常数
,重复实验,该反应的平衡常数
_______  (填“>”“<”或“=”),理由为
(填“>”“<”或“=”),理由为_______ 。
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是
A.
B.少量
C.
D.
(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol

①图中能表示CO的平衡体积分数与温度关系的曲线为
②T1 ℃时,
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是
A.增大压强 B.充入一定量
④向起始温度为
2019·甘肃·一模
类题推荐
“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳及其化合物的综合利用成为研究的热点。
(1)下列事实中,能用来比较碳元素和硫元素的非金属性强弱的是_______ (填字母)。
A. SO2具有漂白性而CO2没有
B. SO2能使酸性 KMnO4溶液褪色而CO2不能
C. H2SO4可与 Na2CO3反应生成CO2
D. Na2CO3溶液显碱性,而Na2SO4溶液显中性
(2)CH4(g) + CO2(g) 2 CO(g) + 2H2(g) 已知上述反应中相关的化学键键能数据如下:
2 CO(g) + 2H2(g) 已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH =_________ 。
(3)工业上可用H2和CO2制备甲醇,其反应为:CO2(g) + 3H2(g) CH3OH( g) + H2O(g);ΔH >0, 某温度下,将 1 mol CO2和 3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH( g) + H2O(g);ΔH >0, 某温度下,将 1 mol CO2和 3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
①只改变下列条件,既能加快该反应的反应速率,又能增大CO2的平衡转化率的是______ (填字母)。
A .增大压强 B.充入一定量的H2 C. 及时移走CH3OH D.加入适当催化剂
②该温度下CO2的平衡转化率为__________ 。
③向2 L绝热容器中充入1 mol CO2和3 mol H2进行上述反应,该反应的平衡常数______ (填“增大”“减小”或“不变”),理由为__________ 。
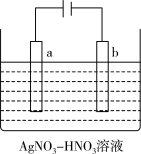
(4)下图为电解精炼银的示意图,_______ (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生.则生成该气体的电极反应式为_________ 。
(1)下列事实中,能用来比较碳元素和硫元素的非金属性强弱的是
A. SO2具有漂白性而CO2没有
B. SO2能使酸性 KMnO4溶液褪色而CO2不能
C. H2SO4可与 Na2CO3反应生成CO2
D. Na2CO3溶液显碱性,而Na2SO4溶液显中性
(2)CH4(g) + CO2(g)
 2 CO(g) + 2H2(g) 已知上述反应中相关的化学键键能数据如下:
2 CO(g) + 2H2(g) 已知上述反应中相关的化学键键能数据如下:化学键 | C—H | C=O | H—H | C≡O(CO) |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH =
(3)工业上可用H2和CO2制备甲醇,其反应为:CO2(g) + 3H2(g)
时间/ h | 1 | 2 | 3 | 4 | 5 | 6 |
P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①只改变下列条件,既能加快该反应的反应速率,又能增大CO2的平衡转化率的是
A .增大压强 B.充入一定量的H2 C. 及时移走CH3OH D.加入适当催化剂
②该温度下CO2的平衡转化率为
③向2 L绝热容器中充入1 mol CO2和3 mol H2进行上述反应,该反应的平衡常数
(4)下图为电解精炼银的示意图,

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网