解答题-原理综合题 较难0.4 引用8 组卷2033
CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
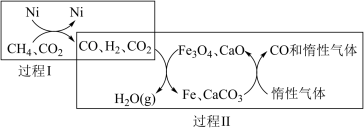
(1)CH4超干重整CO2的催化转化如图所示:
①已知相关反应的能量变化如图所示:
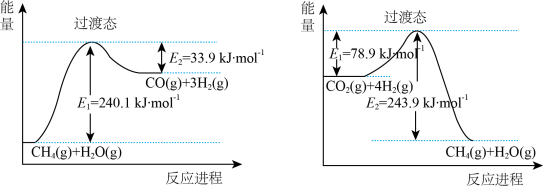
过程Ⅰ的热化学方程式为________ 。
②关于上述过程Ⅱ的说法不正确的是________ (填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
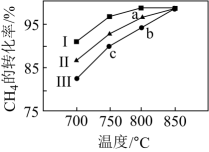
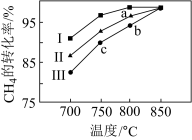
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________ (填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________ 。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。
①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________ kPa,υ(CO)=________ mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________ (kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中 ,则此时溶液的pH=
,则此时溶液的pH=________ 。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
(1)CH4超干重整CO2的催化转化如图所示:

①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为
②关于上述过程Ⅱ的说法不正确的是
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中
2019·山东潍坊·二模
类题推荐
甲烷是一种重要的化工原料,广泛应用于民用和工业中。回答下列问题:
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。 △H1
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ∙mol–1
③H2(g)+ O2(g)=H2O(g) △H3=-242kJ∙mol–1
O2(g)=H2O(g) △H3=-242kJ∙mol–1
相关化学键的键能数据如下:
由此计算△H1=___________ kJ∙mol–1。
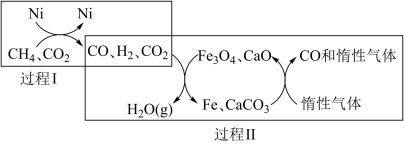
(2)CH4超干重整CO2的催化转化如图所示:

①关于上述过程II的说法正确的是___________ (填序号)。
A.CO未参与反应 B.可表示为CO2(g)+H2(g)⇌H2O(g)+CO(g)
C.实现了含碳物质与含氢物质的分离 D.Fe3O4、CaO为催化剂,降低了反应的△H
②在体积为2L的刚性密闭容器中,充入2molCH4和3molCO2,加入Ni/α-Al2O3催化剂并加热至T1使其发生反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),容器内的总压强p随时间t的变化如下表所示:
i.该温度下的平衡常数Kp=___________ kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
ii.实验测得v正=k正·c(CH4)·c(CO2),v逆=k逆·c2(CO)·c2(H2),其中k正、k逆为速率常数仅与温度有关,T1温度时, =
=___________ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正___________ v逆(填“>”、“<”或“=”)。
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中c(H2C2O4)=c( ),则此时溶液的pH=
),则此时溶液的pH=___________ 。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
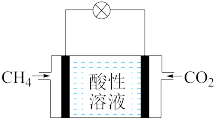
(4)模拟利用CH4与CO2反应制草酸(H2C2O4)的电池,装置如图所示(电极均为惰性材料),则充入CH4一极为电池的___________ 极(填正”或“负”),此极发生的电极方程式为___________ 。
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)。 △H1
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ∙mol–1
③H2(g)+
相关化学键的键能数据如下:
| 共价键 | H-O | C≡O | H-H | C-H |
| 键能/(kJ∙mol–1) | 463 | 1076 | 436 | 413 |
(2)CH4超干重整CO2的催化转化如图所示:

①关于上述过程II的说法正确的是
A.CO未参与反应 B.可表示为CO2(g)+H2(g)⇌H2O(g)+CO(g)
C.实现了含碳物质与含氢物质的分离 D.Fe3O4、CaO为催化剂,降低了反应的△H
②在体积为2L的刚性密闭容器中,充入2molCH4和3molCO2,加入Ni/α-Al2O3催化剂并加热至T1使其发生反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),容器内的总压强p随时间t的变化如下表所示:
| 反应时间 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 总压强p/kPa | 10.0 | 11.5 | 12.3 | 13.0 | 13.6 | 14.0 | 14.0 |
ii.实验测得v正=k正·c(CH4)·c(CO2),v逆=k逆·c2(CO)·c2(H2),其中k正、k逆为速率常数仅与温度有关,T1温度时,
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中c(H2C2O4)=c(
(4)模拟利用CH4与CO2反应制草酸(H2C2O4)的电池,装置如图所示(电极均为惰性材料),则充入CH4一极为电池的

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网