解答题-原理综合题 适中0.65 引用4 组卷183
绿水青山就是金山银山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①

②NO(g)+CO(g)
 N2(g)+CO2(g)
N2(g)+CO2(g)
③2NO(g)+O2(g) 2NO2(g)
2NO2(g)
反应 的
的
________  ;某温度下,反应①②③的平衡常数分别カ
;某温度下,反应①②③的平衡常数分别カ 、
、 、
、 ,则该反应的K=
,则该反应的K=________ (用 、
、 、
、 表示)。
表示)。
(2)温度为 ℃时,在四个容积均为1L的恒容密闭容器中发生反应:
℃时,在四个容积均为1L的恒容密闭容器中发生反应:

 ,测得有关实验数据如下:
,测得有关实验数据如下:
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________ 。
②温度不变,容器Ⅲ中达到平衡后再充入NO、 (g)各
(g)各 mol,则反应将向
mol,则反应将向_____________ 。(填“正”或“逆”)方向进行。
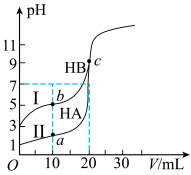
(3)常温下用0.100 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[ ]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于
 的是
的是________________ ,原因为_____________________ 。
②化学反应往往伴有热效应若为绝热体系a的温度______________ (填“>”,“=”或“<”)c点的温度。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①
②NO(g)+CO(g)
③2NO(g)+O2(g)
反应
(2)温度为
| 容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
| Ⅰ | |||
| Ⅱ | |||
| Ⅲ | |||
| Ⅳ | |||
②温度不变,容器Ⅲ中达到平衡后再充入NO、
(3)常温下用0.100

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于
②化学反应往往伴有热效应若为绝热体系a的温度
2019·辽宁·二模
类题推荐
“低碳经济”备受关注,研究和深度开发CO2的应用对构建生态文明社会具有重要的意义。
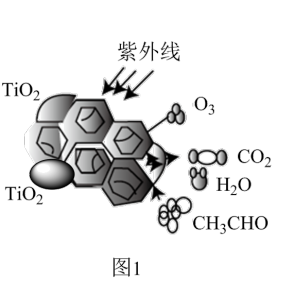
(1)TiO2是一种性能优良的光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图1为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为_______ 。
(2)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g) △H=+247.3kJ/mol。为了探究反应CO2(g)+CH4(g)
2CO(g)+2H2(g) △H=+247.3kJ/mol。为了探究反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,并使二者物质的量浓度均为1.0mol/L,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,并使二者物质的量浓度均为1.0mol/L,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线_______ (填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为_______ (填字母)。
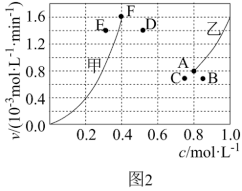
(3)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得的有关数据如表(t1<t2<t3):
2NH3(g)+CO2(g)。实验测得的有关数据如表(t1<t2<t3):
氨基甲酸铵的分解反应是_______ (填“放热”或“吸热”)反应。在15℃,此反应的化学平衡常数K=_______ 。
②将一定量纯净的NH2COONH4固体置于恒温恒容的真空密闭容器中,发生反应:NH2COONH4(s) 2NH3(g)+CO2(g)。能判断该反应达到化学平衡状态的是
2NH3(g)+CO2(g)。能判断该反应达到化学平衡状态的是_______ 。(填序号)
a.v(NH3)=2v(CO2) b.气体的总压强不变
c.气体的总质量不变 d.混合气体的平均相对分子质量不变
e.CO2的体积分数不变 f.NH2COONH4的物质的量浓度恒定不变
g.混合气体的密度不变
③在NH4HCO3溶液中,反应NH +HCO
+HCO +H2O
+H2O NH3•H2O+H2CO3的平衡常数K=1.25×10-3。已知常温下H2CO3的电离平衡常数Ka1=4×10-7,则NH3•H2O的电离平衡常数Kb=
NH3•H2O+H2CO3的平衡常数K=1.25×10-3。已知常温下H2CO3的电离平衡常数Ka1=4×10-7,则NH3•H2O的电离平衡常数Kb=_______ 。
(1)TiO2是一种性能优良的光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图1为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为

(2)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应:CO2(g)+CH4(g)

(3)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)
| 温度/℃ 气体总浓度/mol·L-1 时间/min | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
氨基甲酸铵的分解反应是
②将一定量纯净的NH2COONH4固体置于恒温恒容的真空密闭容器中,发生反应:NH2COONH4(s)
a.v(NH3)=2v(CO2) b.气体的总压强不变
c.气体的总质量不变 d.混合气体的平均相对分子质量不变
e.CO2的体积分数不变 f.NH2COONH4的物质的量浓度恒定不变
g.混合气体的密度不变
③在NH4HCO3溶液中,反应NH
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网