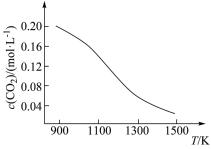
解答题-原理综合题 适中0.65 引用2 组卷310
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____ 。
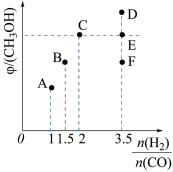
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
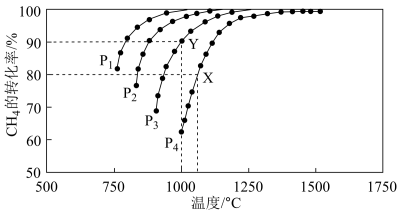
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因___________ 。
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为_____ ,该温度下,反应的平衡常数为_________ (保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________ 。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向__________ (填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为__________________ 。
(1)已知CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)
 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)
 CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向
2019·宁夏银川·二模
类题推荐
实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0=______ kJ·mol-1
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
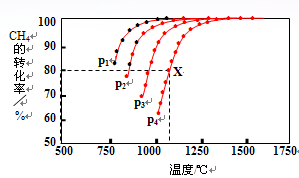
据图可知,p1、p2、 p3、p4由大到小的顺序____________ 。
(3)CO和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。
CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是_____________
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K=___________ 。
若此时增大压强,平衡将向_______ (填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。_____
 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0=
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
据图可知,p1、p2、 p3、p4由大到小的顺序
(3)CO和H2还可以通过反应C(s)+H2O(g)
 CO(g)+H2 (g) 制取。
CO(g)+H2 (g) 制取。① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是
| A.体系压强不再变化 | B.CO与H2的物质的量之比为1:1 |
| C.混合气体的密度保持不变 | D.每消耗1mol H2O(g)的同时生成1mol H2 |
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K=
若此时增大压强,平衡将向
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网