解答题-原理综合题 困难0.15 引用7 组卷1188
氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________ .
②过程(Ⅰ)和过程(Ⅱ)的反应热________ (填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________ .
b.N2的平衡转化率为________ .
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________ (填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g) 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____ (用含a、c的代数式表示),K3=_____ (用K1和K2表示).反应Ⅲ中的ΔS______ (填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
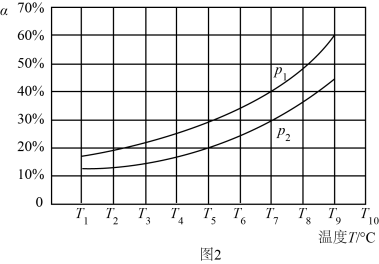
①分析得p1________ p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________ (填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
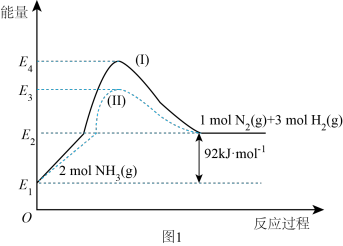
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为
②过程(Ⅰ)和过程(Ⅱ)的反应热
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为
b.N2的平衡转化率为
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1反应Ⅱ:N2(g)+O2(g)
 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2反应Ⅲ:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3则反应Ⅱ中的b=
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:

①分析得p1
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
18-19高二下·四川南充·期中
类题推荐
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g) 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________ (用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
则2NO(g)+Cl2(g) 2ClNO(g)的反应的 △H和a的关系为 △H =
2ClNO(g)的反应的 △H和a的关系为 △H = ___ kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g) 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
n = ___ ;k = ____ 。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g) 2ClNO(g),能判断反应已达到化学平衡状态的是
2ClNO(g),能判断反应已达到化学平衡状态的是__ (填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g) 2ClNO(g)△H。
2ClNO(g)△H。
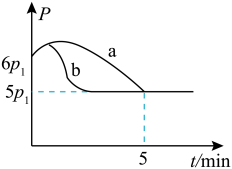
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H__ (填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______ 。
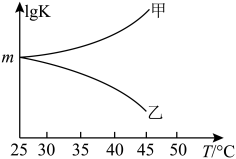
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____ (填“甲”或“乙”),m值为_____ 。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
| 化学键 | N≡O | Cl-Cl | Cl-N | N==O |
| 键能/(kJ·mol-1) | 630 | 243 | a | 607 |
(3)300℃时,2NO(g)+Cl2 (g)
| 序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
| ① | 0. 30 | 3. 60×10-9 |
| ② | 0. 60 | 1. 44×10-8 |
| ③ | 0. 90 | 3. 24×10-8 |
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是
氨作为重要化工原料,被大量应用于工业生产。氨在不同催化剂条件下可发生下列两个反应:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH1=-905.0kJ·mol-1
4NO(g)+6H2O(g)ΔH1=-905.0kJ·mol-1
反应Ⅱ:4NH3(g)+3O2(g) 2N2(g)+6H2O(g)ΔH2=-1266.6kJ·mol-1
2N2(g)+6H2O(g)ΔH2=-1266.6kJ·mol-1
(1)写出NO分解生成N2与O2的热化学方程式:___ 。
(2)反应Ⅰ在容积固定的密闭容器中进行,容器内部分物质的物质的量浓度如表:
①反应从开始到第2min时,v(H2O)=___ 。
②在第3min时,改变的反应条件可能是___ (填序号)。
a.使用催化剂 b.减小压强 c.升高温度 d.增加O2的浓度
③.该反应达到平衡状态的标志是___ (填序号)。
a.在恒温恒容的容器中,混合气体的密度不再变化
b.单位时间内消耗nmolNO的同时消耗nmolNH3
c.百分含量w(NH3)=w(NO)
d.反应速率v(NH3)﹕v(O2)﹕v(NO)﹕v(H2O)=4﹕5﹕4﹕6
(3)若在容积为2L的密闭容器中充入8molNH3(g)和6molO2(g),发生反应Ⅱ。保持其他条件不变,在相同时间内测得c(N2)与温度的关系如图所示。在T1℃下,NH3的平衡转化率为___ 。图中a、c两点对应的容器内部压强pa___ pc(填“>”“<”或“=”)。
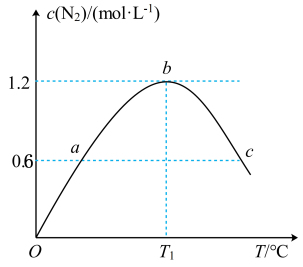
反应Ⅰ:4NH3(g)+5O2(g)
反应Ⅱ:4NH3(g)+3O2(g)
(1)写出NO分解生成N2与O2的热化学方程式:
(2)反应Ⅰ在容积固定的密闭容器中进行,容器内部分物质的物质的量浓度如表:
| 浓度 时间 | |||
| 第0min | 0.8 | 1.6 | 0 |
| 第2min | 0.3 | 0.975 | 0.5 |
| 第3min | 0.3 | 0.975 | 0.5 |
| 第4min | 0.7 | 1.475 | 0.1 |
①反应从开始到第2min时,v(H2O)=
②在第3min时,改变的反应条件可能是
a.使用催化剂 b.减小压强 c.升高温度 d.增加O2的浓度
③.该反应达到平衡状态的标志是
a.在恒温恒容的容器中,混合气体的密度不再变化
b.单位时间内消耗nmolNO的同时消耗nmolNH3
c.百分含量w(NH3)=w(NO)
d.反应速率v(NH3)﹕v(O2)﹕v(NO)﹕v(H2O)=4﹕5﹕4﹕6
(3)若在容积为2L的密闭容器中充入8molNH3(g)和6molO2(g),发生反应Ⅱ。保持其他条件不变,在相同时间内测得c(N2)与温度的关系如图所示。在T1℃下,NH3的平衡转化率为

氮及其化合物在工农业生产、生活中有着重要应用。
(1)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
则 CH4 脱硝的热化学方程式为 CH4 (g) + 4NO (g)⇌CO2 (g) + 2N2 (g) + 2H2O ΔH=_________ kJ/mol(用 a、b 表示);平衡常数 K3=_________ (用 K1、K2 表示)。
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)⇌N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为_________ 。达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则此平衡将_________ (填“正向移动”“不移动”或“逆向移动”)。
②能判断该反应一定达到化学平衡状态的依据是_________ (填标号)。
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)某实验小组模拟4CO(g)+2NO2(g) ⇌4CO2(g)+N2(g) ΔH=-1200kJ·mol-1净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________ ;两种方式达平衡时,N2的体积分数:甲______ 乙(填“>、=、<或不确定”)
(1)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
| 反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
| CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
| N2(g)+O2(g)═2NO(g) | b | K2 |
则 CH4 脱硝的热化学方程式为 CH4 (g) + 4NO (g)⇌CO2 (g) + 2N2 (g) + 2H2O ΔH=
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)⇌N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为
②能判断该反应一定达到化学平衡状态的依据是
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)某实验小组模拟4CO(g)+2NO2(g) ⇌4CO2(g)+N2(g) ΔH=-1200kJ·mol-1净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为
| 甲 | 乙 |
| 0.2molNO2 | 0.1molNO2 |
| 0.4molCO | 0.2molCO |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


