解答题-实验探究题 适中0.65 引用1 组卷160
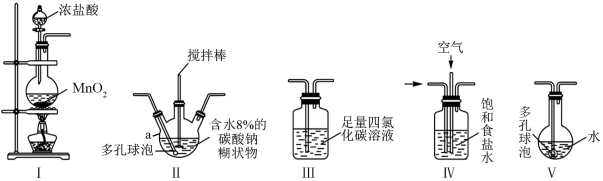
一氧化二氯(Cl2O)具有强氧化性,能与有机物发生剧烈反应,与水反应生成次氯酸,Cl2O的熔点为−120 ℃,沸点为2.0 ℃。Cl2的沸点为−34.6 ℃。制备原理:HgO(红色粉末)+2Cl2=HgCl2(白色粉末)+Cl2O。某小组设计如下实验制备一氧化二氯(导管接口有一段橡胶管省略):
回答下列问题:
(1)C中发生反应的现象是_______________ 。
(2)气流从左至右,导管口连接顺序为a→_______________________ →j(填字母)。
(3)写出A中反应的离子方程式______________________________ 。
(4)C、D装置的橡胶管接口内衬锡箔,其目的是______________________________ 。
(5)取少量产品于试管中,____________________ (补充步骤和现象),证明Cl2O的水溶液有漂白性。
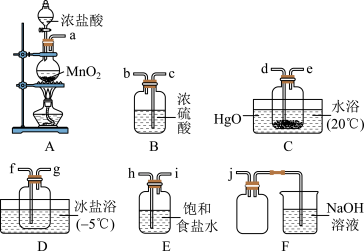
(6)实验完毕后,为测定A装置烧瓶中残留溶液中盐酸的浓度进行如下实验:

取烧瓶中溶液100 mL按如图所示装置进行实验,实验前量气管读数为x mL,当Y形管不再产生气泡时,每隔半分钟读数一次,当两次读数相等时调平量气管和烧杯内液面,读数为y mL(都已折合成标准状况)。
①每隔半分钟读数一次,其目的是__________________ 。调平液面的操作是__________ 。
②该溶液中c(HCl)=_______________ mol·L1(用含x和y的代数式表示)。

回答下列问题:
(1)C中发生反应的现象是
(2)气流从左至右,导管口连接顺序为a→
(3)写出A中反应的离子方程式
(4)C、D装置的橡胶管接口内衬锡箔,其目的是
(5)取少量产品于试管中,
(6)实验完毕后,为测定A装置烧瓶中残留溶液中盐酸的浓度进行如下实验:

取烧瓶中溶液100 mL按如图所示装置进行实验,实验前量气管读数为x mL,当Y形管不再产生气泡时,每隔半分钟读数一次,当两次读数相等时调平量气管和烧杯内液面,读数为y mL(都已折合成标准状况)。
①每隔半分钟读数一次,其目的是
②该溶液中c(HCl)=
2019高三下·全国·专题练习
类题推荐
某兴趣小组同学们对SO2的性质进行探究。
实验一:探究SO2的漂白原理,装置如图所示,部分装置省略。实验发现,装置B中溶液变红色,不褪色;装置C中溶液为红色,装置D中溶液褪色。向烧瓶中加入200mL18.4mol/L浓硫酸,充分反应直至装置A中反应停止。
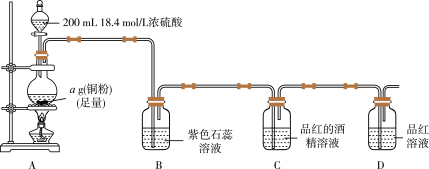
回答下列问题:
(1)装置A中发生反应的化学方程式为_______ 。
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;
猜想2:HSO ;
;
猜想3:_______ 。
针对猜想2设计简单实验探究漂白原理:_______ 。
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数正确的先后操作顺序是_______ (填字母)。
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况,且V2>V1)。则铜与浓硫酸发生反应的最低硫酸浓度为_______ mol/L。
实验二:结合实验一的装置,乙同学添加一些装置(如图),利用SO2和Cl2在活性炭催化作用下制取亚硫酰氯SOCl2。亚硫酰氯是重要的化工试剂,沸点较低,易水解。
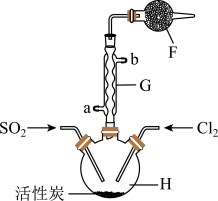
(4)①G仪器的进水口是_______ (填“a”或“b”),其作用是_______ 。
②F仪器的作用是_______ 。
(5)已知SOCl2具有还原性,其氧化产物为SO 。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
实验一:探究SO2的漂白原理,装置如图所示,部分装置省略。实验发现,装置B中溶液变红色,不褪色;装置C中溶液为红色,装置D中溶液褪色。向烧瓶中加入200mL18.4mol/L浓硫酸,充分反应直至装置A中反应停止。

回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;
猜想2:HSO
猜想3:
针对猜想2设计简单实验探究漂白原理:
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数正确的先后操作顺序是
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况,且V2>V1)。则铜与浓硫酸发生反应的最低硫酸浓度为
实验二:结合实验一的装置,乙同学添加一些装置(如图),利用SO2和Cl2在活性炭催化作用下制取亚硫酰氯SOCl2。亚硫酰氯是重要的化工试剂,沸点较低,易水解。

(4)①G仪器的进水口是
②F仪器的作用是
(5)已知SOCl2具有还原性,其氧化产物为SO
| A.滴加几滴KSCN溶液,溶液变为红色 |
| B.滴加几滴BaCl2溶液,有白色沉淀生成 |
| C.加入少量稀硝酸,再滴加几滴BaCl2溶液,有白色沉淀生成 |
| D.滴加几滴酸性KMnO4溶液,紫红色消失 |
亚硝酰氯(NOCl)是一种黄色气体,熔点为-64.5℃,沸点为-5.5℃,常用于合成洗涤剂、触媒及用作中间体,可由NO(NO与浓硫酸不反应)与Cl2 在通常条件下反应得到。某实验小组设计实验制备NOCl并测定产品中NOCl的含量。
步骤1.制备NOCl——按如图所示装置进行实验(夹持装置略)。
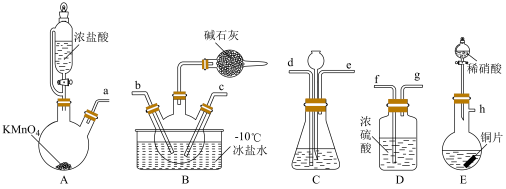
(1)仪器连接的顺序为A→___________ →___________ →B,E→___________ →B(填装置字母代号,可重复使用); 装置C中所盛试剂的名称是___________ 。
(2)写出E中发生反应的离子方程式为___________ 。
步骤2.NOCl含量的测定(假设杂质不参与反应)
①取5.000g三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量N2,将NO全部赶出,最后将溶液稀释至500.00 mL;
②取25.00 mL 上述所得溶液,用淀粉作指示剂,用0.15mol·L-1 Na2S2O3标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
已知:①NOCl+H2O=NO +2H++Cl-
+2H++Cl-
②______NO +______H++_______I-=_______NO↑+_______+_______I2
+______H++_______I-=_______NO↑+_______+_______I2
③I2+2S2O =S4O
=S4O +2I-
+2I-
(3)配平反应②并标出电子转移的方向和数目___________ 。
______NO +______H++_______I-=_______NO↑+_______+_______I2
+______H++_______I-=_______NO↑+_______+_______I2
结合相关数据,计算实验测得产品中NOCl 的含量为___________ (保留三位有效数字)。
(4)下列操作将导致 NOCl 测量含量偏低的是___________。
步骤1.制备NOCl——按如图所示装置进行实验(夹持装置略)。

(1)仪器连接的顺序为A→
(2)写出E中发生反应的离子方程式为
步骤2.NOCl含量的测定(假设杂质不参与反应)
①取5.000g三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量N2,将NO全部赶出,最后将溶液稀释至500.00 mL;
②取25.00 mL 上述所得溶液,用淀粉作指示剂,用0.15mol·L-1 Na2S2O3标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
已知:①NOCl+H2O=NO
②______NO
③I2+2S2O
(3)配平反应②并标出电子转移的方向和数目
______NO
结合相关数据,计算实验测得产品中NOCl 的含量为
(4)下列操作将导致 NOCl 测量含量偏低的是___________。
| A.滴定过程中剧烈振荡导致 I2 挥发 |
| B.滴定前滴定管有气泡,滴定后气泡消失 |
| C.锥形瓶内溶液蓝色消失后立即读数 |
| D.滴定管用蒸馏水润洗后,直接加入Na2S2O3标准溶液进行滴定 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网