解答题-工业流程题 适中0.65 引用2 组卷527
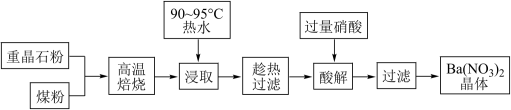
重晶石主要成分为BaSO4,含少量的SiO2、CaO和MgO杂质,以下是一种制取Ba(NO3)2的工业流程。
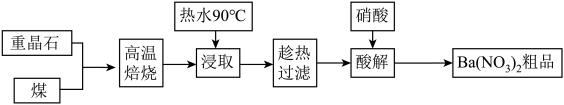
(1)上述流程中将重晶石和煤磨成粉状的目的是_______________________ 。
(2)焙烧过程中主反应为:BaSO4 + 4C BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
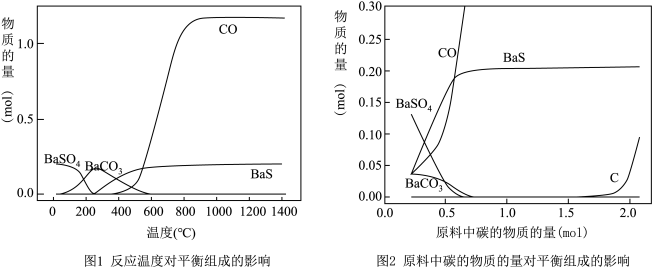
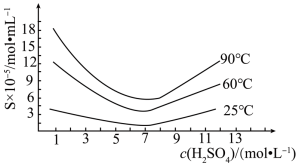
①依据如图判断生成BaS的反应是_______ 反应(填“放热”或“吸热”);反应温度至少应控制在____ 以上。
②控制BaSO4的量不变,改变C的量,测得原料中碳的物质的量对平衡组成的影响,如图所示,判断原料中n(C) / n(BaSO4)至少为________ (填字母):a. 1.5 、b. 2.0 、c.3.75。
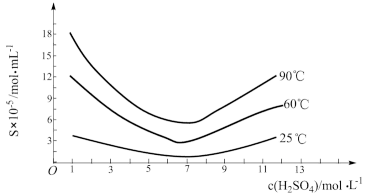
(3)已知BaS的溶解度随温度的升高而明显增大,90℃时约为50g/100g水,浸取液中存在三种碱Mg(OH)2 、Ca(OH)2、Ba(OH)2。
①浸取过程中产生Ba(OH)2的原因是________________________ (写离子方程式)。
②三种碱的碱性由强到弱顺序为:_________ >_______ >________ (填化学式);结合元素周期律解释原因是:Mg、Ca、Ba处于同一主族,随着原子序数递增,________ 。
(4)酸解过程中,向滤液中加入硝酸,即有硝酸钡晶体析出,稍过量的HNO3有利于提高Ba(NO3)2晶体的析出率,用化学平衡原理分析其原因是:__________________________ 。

(1)上述流程中将重晶石和煤磨成粉状的目的是
(2)焙烧过程中主反应为:BaSO4 + 4C
 BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
BaS + 4CO,除此以外还可能有BaCO3等副产物生成,通过改变温度以及煤粉的用量可降低副反应发生。
①依据如图判断生成BaS的反应是
②控制BaSO4的量不变,改变C的量,测得原料中碳的物质的量对平衡组成的影响,如图所示,判断原料中n(C) / n(BaSO4)至少为
(3)已知BaS的溶解度随温度的升高而明显增大,90℃时约为50g/100g水,浸取液中存在三种碱Mg(OH)2 、Ca(OH)2、Ba(OH)2。
①浸取过程中产生Ba(OH)2的原因是
②三种碱的碱性由强到弱顺序为:
(4)酸解过程中,向滤液中加入硝酸,即有硝酸钡晶体析出,稍过量的HNO3有利于提高Ba(NO3)2晶体的析出率,用化学平衡原理分析其原因是:
2019·广东肇庆·三模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网