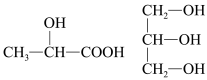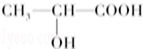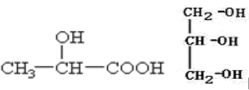填空题 适中0.65 引用1 组卷671
(1)仅由第二周期元素组成的共价分子中,互为等电子体的是:_______ 和_____ ;_____ 和______ 。
(2)HF的沸点比HCl的高,原因是____ ;SiH4的沸点比CH4的高,原因是________ 。
(3)在下列物质①P4 ②NH3 ③HCN ④BF3 ⑤H2O ⑥SO3 ⑦CH3Cl中,属于含有极性键的极性分子的是(填序号)_______ 。
(4)根据价层电子对互斥理论判断下列问题:
CO2分子中,中心原子的杂化方式为__ 杂化,分子的立体构型为________ 。
SO32-中,中心原子的杂化方式为__ 杂化,离子的立体构型为_________ 。
HCHO分子中,中心原子的杂化方式为__ 杂化,分子的立体构型为_________ 。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO4_____ HClO2 H2CO3______ H2SiO3 H2SO3_______ H2SO4
(2)HF的沸点比HCl的高,原因是
(3)在下列物质①P4 ②NH3 ③HCN ④BF3 ⑤H2O ⑥SO3 ⑦CH3Cl中,属于含有极性键的极性分子的是(填序号)
(4)根据价层电子对互斥理论判断下列问题:
CO2分子中,中心原子的杂化方式为
SO32-中,中心原子的杂化方式为
HCHO分子中,中心原子的杂化方式为
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):
HClO4
18-19高二下·甘肃武威·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网