填空题 适中0.65 引用1 组卷137
NF3是一种有毒、无味、无色的气体,NF3气体作为刻蚀剂和清洗剂在电子工业中有广泛的应用,回答下列问题:
(1)F2和液氨直接反应可制备NF3,反应的化学方程式为_____________________ 。反应过程中会涉及副反应:4F2+2NH3=N2F2+6HF,其中N2F2的结构式可表示为_______________ 。
(2)F2和固态(NH4)3AlF6反应可制备NF3,反应的化学方程式为:(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4,NH4AlF4+3F2=NF3+4HF+AlF3。若1 mol F2参加反应,最多可制得NF3______ mol,此时反应中转移电子______ mol。
(3)工业上用惰性电极电解含HF、NH4F等无水熔融物的方法生产NF3。电解过程中阳极的电极反应式为_______________________ ,阴极的电极反应式为______________________ 。
(4)一定条件下,向一带活塞的密闭容器中充入1 mol NF3气体,此时容器的体积为V L,在该条件下发生反应2NF3 N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为
N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为_________ mol·L−1。
(1)F2和液氨直接反应可制备NF3,反应的化学方程式为
(2)F2和固态(NH4)3AlF6反应可制备NF3,反应的化学方程式为:(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4,NH4AlF4+3F2=NF3+4HF+AlF3。若1 mol F2参加反应,最多可制得NF3
(3)工业上用惰性电极电解含HF、NH4F等无水熔融物的方法生产NF3。电解过程中阳极的电极反应式为
(4)一定条件下,向一带活塞的密闭容器中充入1 mol NF3气体,此时容器的体积为V L,在该条件下发生反应2NF3
2019高三下·全国·专题练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
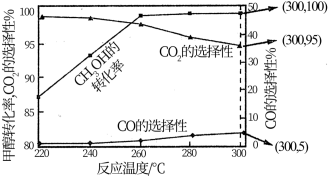
 H2S(g)+CO(g)
H2S(g)+CO(g) 。
。 H2S (g)+CO(g)
H2S (g)+CO(g)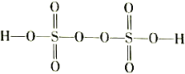 。
。

