解答题-原理综合题 适中0.65 引用3 组卷929
砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___ ;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___ 。
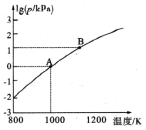
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___ ;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g) H=
H=_______ kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
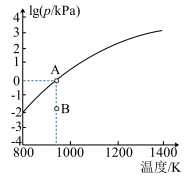
①对应温度下,B点的反应速率v(正)___ v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___ kPa,该反应的Kp=___ kPa5 (Kp为以分压表示的平衡常数)。
(1)ASH3的电子式为
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g)
As2O3(g)+3C(s)=1/2As4(g)+3CO(g)
则反应4As(g)=As4(g)
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正)
②A点处,AsS(g)的分压为
2019·广东·一模
类题推荐
乙炔广泛用于焊接、焊割及有机合成等方面。
(1)已知下列热化学方程式:
4CH4 (g)+3O2(g)==2C2H2(g)+6H2O(g) △H1=a kJ•mol-1;
2H2(g)+O2(g)==2H2O(g) △H2=b kJ•mol-1;
2CH4(g)==C2H2(g)+3H2 (g) △H3
①△H3=____________________ (用含a、b的代数式表示)kJ•mol-1。
②已知下列共价键的键能数据:
则△H3=____________________ (填数值)kJ•mol-1。
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为__________________________ 。
(3)向压强为1.0×104 kPa的恒压密闭容器中充入1 mol乙炔和1 mol HCl气体,在催化剂作用下乙炔与HCl发生反应:HC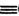 CH(g)+HCl(g)
CH(g)+HCl(g) CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
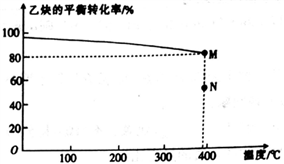
①该反应的△H__________ (填“>”或“<”)0,N点时乙炔的反应速率v(正)________ (填“>”或“<” 或“=”) v(逆)。
② M点对应温度下,该反应的平衡常数Kp=_________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(kPa)-1,
(1)已知下列热化学方程式:
4CH4 (g)+3O2(g)==2C2H2(g)+6H2O(g) △H1=a kJ•mol-1;
2H2(g)+O2(g)==2H2O(g) △H2=b kJ•mol-1;
2CH4(g)==C2H2(g)+3H2 (g) △H3
①△H3=
②已知下列共价键的键能数据:
| 共价键 | C—H | H—H | C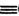 C C |
| 键能/ kJ•mol-1 | 413.4 | 436 | 812 |
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为
(3)向压强为1.0×104 kPa的恒压密闭容器中充入1 mol乙炔和1 mol HCl气体,在催化剂作用下乙炔与HCl发生反应:HC
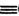 CH(g)+HCl(g)
CH(g)+HCl(g) CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
CH2==CHCl(g),乙炔的平衡转化率与温度的关系如图所示。
①该反应的△H
② M点对应温度下,该反应的平衡常数Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 3MnO(s)+5CO(g) Kp(I)
3MnO(s)+5CO(g) Kp(I)

