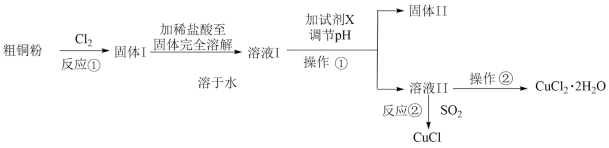
解答题-实验探究题 适中0.65 引用3 组卷389
氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。
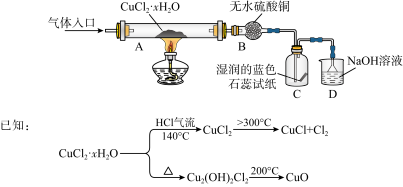
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________ 。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________ 。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息分析:
① 若杂质是CuCl2,则产生的原因可能是____________________________________ 。
② 若杂质是CuO,则产生的原因可能是_____________________________________ 。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______ (填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________ (精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________

完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是
(2)实验过程中需要全程通入干燥的HCl,其作用是
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息分析:
① 若杂质是CuCl2,则产生的原因可能是
② 若杂质是CuO,则产生的原因可能是
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。
2019·上海虹口·二模
类题推荐
氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如下所示:

已知:氯化过程主要发生反应6Ca(OH)2 + 6Cl2 5CaCl2+Ca(ClO)2+6H2O
5CaCl2+Ca(ClO)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是____________ 。
(2)氯化过程需要控制较高温度,其目的有:
①________________ ; ②减少 Cl2 与 Ca(OH)2 之间的副反应。
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:_____________________ 。
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_________________ 。
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
①进行加热操作时,应将固体置于_________ (填仪器名称)中。
②该实验不必进行第五次加热的原因是_________________ 。
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。
______________________

已知:氯化过程主要发生反应6Ca(OH)2 + 6Cl2
 5CaCl2+Ca(ClO)2+6H2O
5CaCl2+Ca(ClO)2+6H2O完成下列填空:
(1)工业生产氯气的方法是
(2)氯化过程需要控制较高温度,其目的有:
①
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量(g) | c | d | e | e |
②该实验不必进行第五次加热的原因是
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网