解答题-原理综合题 适中0.65 引用1 组卷561
深入研究碳元素的化合物有重要意义,回答下列问题:
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s) CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________ 。
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
(2)工业上可以通过反应CO(g)+2H2(g) CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H_______ 0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____ v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________ L。

(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是_________________
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=__________ (保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7 Ka2(H2CO3)=4.7×10-11)
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为____________________ 。该电池充电时,当转移2mol电子时,阳极质量的变化量为______ g。
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
(2)工业上可以通过反应CO(g)+2H2(g)

(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为
2019·安徽黄山·二模
类题推荐
回答下列问题:
I.甲醇的合成:在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。

(1)A、B两点对应的压强大小关系是pA___________ pB(填“>、<、=”)。
(2)A、B、C三点的平衡常数KA,KB,KC的大小关系是___________ 。
(3)下列叙述能说明上述反应能达到化学平衡状态的是___________ (填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(4)在p1压强、T1℃时,经5min达到化学平衡,则用氢气表示该反应的化学速率v(H2)=___________ ,再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大,不变,减小”)。
Ⅱ.工业合成氨原理为:N2(g)+3H2(g)⇌2NH3(g),在T1℃时,向2L恒容密闭容器中充入1molN2和3molH2发生上述反应,测得N2的体积分数φ(N2)随时间(t)的变化如下表:
请回答下列问题:
(5)N2的平衡转化率为___________ (保留三位有效数字)。
(6)若反应开始时,容器内的压强为0.6MPa,则第40min末时容器内的压强为___________ MPa;该反应在T1℃时的压强平衡常数Kp=___________ (MPa)-2(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.甲醇的合成:在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)

(1)A、B两点对应的压强大小关系是pA
(2)A、B、C三点的平衡常数KA,KB,KC的大小关系是
(3)下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(4)在p1压强、T1℃时,经5min达到化学平衡,则用氢气表示该反应的化学速率v(H2)=
Ⅱ.工业合成氨原理为:N2(g)+3H2(g)⇌2NH3(g),在T1℃时,向2L恒容密闭容器中充入1molN2和3molH2发生上述反应,测得N2的体积分数φ(N2)随时间(t)的变化如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| φ(N2) | 0.250 | 0.225 | 0.210 | 0.203 | 0.200 | 0.200 |
(5)N2的平衡转化率为
(6)若反应开始时,容器内的压强为0.6MPa,则第40min末时容器内的压强为
甲醇气相脱水制甲醚的反应可表示为:2CH3OH(g) CH3OCH3(g)+H2O(g),请回答下列问题:
CH3OCH3(g)+H2O(g),请回答下列问题:
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是____ 。
(2)200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
①10~30min内,用CH3OCH3(g)表示该反应的平均速率为____ 。
②CH3OH(g)的平衡转化率为____ 。
③反应开始时,容器内的压强为p0,第40min末时容器内的压强为p1,则p1:p0=____ ;该反应在200℃时的平衡常数Kp=____ (以分压表示,分压=总压×物质的量分数)。
④200℃时,向该容器中投入三种成分的浓度如表:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)____ v逆(CH3OH)(填“>”“<”或“=”),说明理由:____ 。
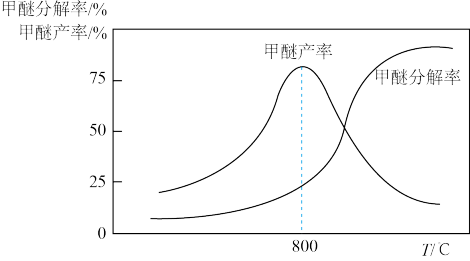
(3)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示,试解释800℃之后甲醇脱水制甲醚产率降低的原因____ 。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是
| A.CH3OCH3(g)和H2O(g)的浓度比保持不变 |
| B.v正(CH3OH)=2v逆(CH3OCH3) |
| C.容器内压强不再变化 |
| D.混合气体的平均相对分子质量不再变化 |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol•L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②CH3OH(g)的平衡转化率为
③反应开始时,容器内的压强为p0,第40min末时容器内的压强为p1,则p1:p0=
④200℃时,向该容器中投入三种成分的浓度如表:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol•L-1) | 0.54 | 0.68 | 0.68 |
(3)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如图所示,试解释800℃之后甲醇脱水制甲醚产率降低的原因

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是

