解答题-实验探究题 适中0.65 引用8 组卷735
某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
(1)探究BaCO3和BaSO4之间的转化
实验操作: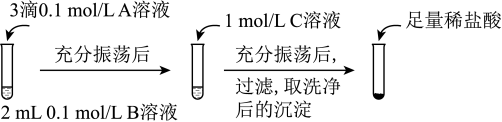
① 实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,______ 。
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______ 。
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______ 。
(2)探究AgCl和AgI之间的转化
实验Ⅲ: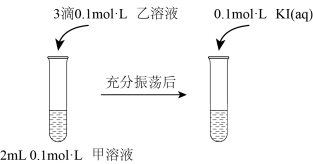
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______ (填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是______ 。
③ 结合信息,解释实验Ⅳ中b<a的原因:______ 。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是______ 。
(3)综合实验Ⅰ~Ⅳ,可得出结论:______ 。
| 物质 | BaSO4 | BaCO3 | AgI | AgCl | |
| 溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
实验操作:

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
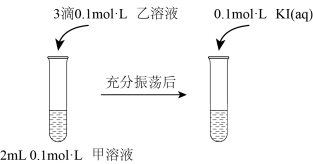
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| 装置 | 步骤 | 电压表读数 | |
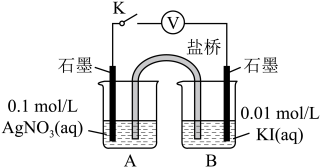 | ⅰ.如图连接装置并加入试剂,闭合K | a | |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
| ⅲ.再向B中投入一定量NaCl (s) | c | ||
| ⅳ.重复ⅰ,再向B中加入与ⅲ等量NaCl(s) | a |
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是
③ 结合信息,解释实验Ⅳ中b<a的原因:
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是
(3)综合实验Ⅰ~Ⅳ,可得出结论:
2019·北京东城·一模
类题推荐
某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
(1)探究BaCO3和BaSO4之间的转化
实验操作:
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,___________ 。
②写出实验Ⅱ中加入C溶液后发生反应的离子方程式是___________ 。
③现有0.34mol的BaSO4沉淀,使用1L饱和Na2CO3溶液(物质的量浓度为 )处理,需要反复处理
)处理,需要反复处理___________ 次,才能使BaSO4全部转化为BaCO3.
(2)探究AgCl和AgI之间的转化
①用化学用语表示AgI的沉淀溶解平衡___________ 。
②25℃时,若使Ag+沉淀完全,则溶液中Cl﹣的浓度至少为___________  。
。
实验Ⅲ: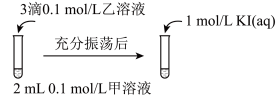
可供选择的试剂有:a.AgNO3溶液 b.NaCl溶液 c.KI溶液
③若要用实验Ⅲ证明AgCl能够转化为AgI,甲溶液应选择___________ (填上方试剂的编号);应用实验Ⅲ的方式,无论怎样选择试剂,学生都无法观察到AgI转化为AgCl,于是又设计了如下实验。
实验Ⅳ:
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
④查阅有关资料可知,Ag+可氧化I﹣,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率___________ (填“大于”或“小于”)沉淀反应速率。设计原电池实验(使用盐桥阻断Ag+与I﹣的相互接触)如上图所示,则该原电池总反应的离子方程式为___________ 。
已知:实验测得电压表读数:a>c>b>0.
⑤结合信息,解释实验Ⅳ中b<a的原因:___________ 。
⑥实验Ⅳ的现象能说明AgI可向AgCl转化,理由是:___________ 。
综合实验Ⅰ~Ⅳ,可得出结论:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现。
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
(1)探究BaCO3和BaSO4之间的转化
实验操作:

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生沉淀部分溶解 |
②写出实验Ⅱ中加入C溶液后发生反应的离子方程式是
③现有0.34mol的BaSO4沉淀,使用1L饱和Na2CO3溶液(物质的量浓度为
(2)探究AgCl和AgI之间的转化
①用化学用语表示AgI的沉淀溶解平衡
②25℃时,若使Ag+沉淀完全,则溶液中Cl﹣的浓度至少为
实验Ⅲ:

可供选择的试剂有:a.AgNO3溶液 b.NaCl溶液 c.KI溶液
③若要用实验Ⅲ证明AgCl能够转化为AgI,甲溶液应选择
实验Ⅳ:
| 装置 | 步骤 | 电压表读数 |
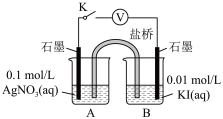 | i.如图连接装置并加入试剂,闭合K | a |
| ii.向B中滴入AgNO3溶液,至沉淀完全 | b | |
| iii.再向B中投入一定量NaCl固体 | c | |
| iv。重复i,再向B中加入与iii等量NaCl固体 | a |
④查阅有关资料可知,Ag+可氧化I﹣,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率
已知:实验测得电压表读数:a>c>b>0.
⑤结合信息,解释实验Ⅳ中b<a的原因:
⑥实验Ⅳ的现象能说明AgI可向AgCl转化,理由是:
综合实验Ⅰ~Ⅳ,可得出结论:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现。
Ⅰ中和热的测定:测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
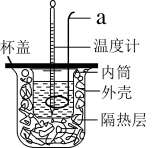
(1)仪器a的名称为_______ ,实验中还需要用到的玻璃仪器是_______ 。
(2)用相同浓度和体积的氨水代替 溶液进行上述实验,测得的中和热数值会偏小,原因为
溶液进行上述实验,测得的中和热数值会偏小,原因为_______ 。
Ⅱ.在试管中进行溶液间反应时,同学们无法观察到 转化为
转化为 ,于是又设计了如下实验(电压表读数:
,于是又设计了如下实验(电压表读数: )。
)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
(3)步骤ⅰ中,B中石墨上的电极反应式是_______ 。
(4)结合信息,解释实验步骤ⅳ中 的原因
的原因_______ 。
(5)能说明 转化为
转化为 的实验现象是
的实验现象是_______ 。

(1)仪器a的名称为
(2)用相同浓度和体积的氨水代替
Ⅱ.在试管中进行溶液间反应时,同学们无法观察到
| 装置 | 步骤 | 电压表读数 |
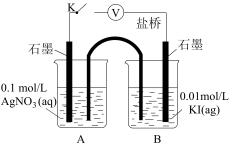 | ⅰ.如图连接装置并加入试剂,闭合K | a |
| ⅱ.向B中滴入 | b | |
| ⅲ.再向B中投入一定量 | c | |
| ⅳ.重复ⅰ,再向B中加入与ⅲ等量 | a |
(3)步骤ⅰ中,B中石墨上的电极反应式是
(4)结合信息,解释实验步骤ⅳ中
(5)能说明
为证明AgCl溶于水存在溶解平衡,取1 mo/LKCl溶液10 mL,向其中加入0.2 mol/LAgNO3溶液1 mL,充分反应后将浊液过滤进行如下实验:
已知:①AgOH不稳定,立即分解为Ag2O (棕褐色或棕黑色),Ag粉为黑色;
②AgCl、Ag2O可溶于浓氨水生成 [Ag(NH3)2]+(银氨溶液),Mg、Ag不溶于浓氨水。
(1)实验A中的滤液所属分散系为___________ 。现象ii中无色气泡是___________ (填化学式)。
(2)现象iii中,导致产生气泡的速率下降的主要原因是___________ 。
(3)判断Mg条表面的棕褐色物质中含有Ag和Ag2O。
①设计实验检验Ag:取实验A中表面变为棕褐色的Mg条于试管中,向其中加入足量稀盐酸,反应结束后,继续加入浓硝酸,产生棕色气体和白色不溶物。用离子方程式表示棕褐色固体中产生Ag的原因:___________ 。实验中加入稀盐酸的目的:___________ 。
②设计检验棕褐色物质中有Ag2O,实验方案是:取实验A中表面变为棕褐色的Mg条用蒸馏水洗净后,加入___________ (填化学式)中浸泡,取上层清液于葡萄糖溶液中,水浴加热,若有___________ (填实验现象),则证明Ag2O存在。
(4)探究AgI转化为AgCl,设计实验如下:
已知:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①电压表读数a>b,其原因是___________ 。
②综合实验现象能说明AgI转化为AgCl,则a、b、c三者的大小关系为___________ 。
| 序号 | 实验装置 | 实验操作 | 实验现象 |
| A |  | 向滤液中放入Mg条 | ⅰ.滤液澄清透明,用激光照射有丁达尔现象。 ⅱ.放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊,ⅲ.一段时间后开始出现棕褐色浑浊物。Mg条表面也逐渐变为棕褐色。产生气泡的速率变缓慢 |
已知:①AgOH不稳定,立即分解为Ag2O (棕褐色或棕黑色),Ag粉为黑色;
②AgCl、Ag2O可溶于浓氨水生成 [Ag(NH3)2]+(银氨溶液),Mg、Ag不溶于浓氨水。
(1)实验A中的滤液所属分散系为
(2)现象iii中,导致产生气泡的速率下降的主要原因是
(3)判断Mg条表面的棕褐色物质中含有Ag和Ag2O。
①设计实验检验Ag:取实验A中表面变为棕褐色的Mg条于试管中,向其中加入足量稀盐酸,反应结束后,继续加入浓硝酸,产生棕色气体和白色不溶物。用离子方程式表示棕褐色固体中产生Ag的原因:
②设计检验棕褐色物质中有Ag2O,实验方案是:取实验A中表面变为棕褐色的Mg条用蒸馏水洗净后,加入
(4)探究AgI转化为AgCl,设计实验如下:
| 装置 | 步骤 | 电压表读数 |
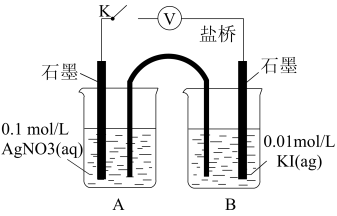 | ⅰ.如图连接装置并加入试剂,闭合K | a |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复ⅰ,再向B中加入与iii等量NaCl(s) | d |
已知:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①电压表读数a>b,其原因是
②综合实验现象能说明AgI转化为AgCl,则a、b、c三者的大小关系为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


