解答题-实验探究题 较难0.4 引用3 组卷639
某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________ 。
(2)写出实验Ⅰ反应的离子方程式:_________________ 。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________ 。
【深入探究】20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________ ,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素 可能是_____________ (写出两条)。__________________ 。
【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
| 实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(2)写出实验Ⅰ反应的离子方程式:
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是
【深入探究】20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2 I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
2019·北京海淀·一模
类题推荐
某兴趣小组对Fe3+与I-的反应进行探究。
Ⅰ.室温下进行下表所列实验。
试填空:
(1)实验2证明实验1中有I2生成,加入的试剂是___________ ,实验现象是___________ 。
(2)上述实验可以证明Fe3+与I-发生可逆反应,原因是___________ 。
(3)实验1中Fe3+与I-反应的离子方程式为___________ 。
Ⅱ.20min后,观察到实验1所得溶液棕黄色变深(标记为溶液b)。小组同学继续对溶液颜色变化的原因进行探究。
查阅资料:i.I-+I2 I
I ,I
,I 呈棕褐色。I-、I
呈棕褐色。I-、I 难溶于CCl4;
难溶于CCl4;
ii.在酸性较强的条件下,I-可被空气氧化为I2.
(4)提出假设:
假设1:溶液中生成了___________ 。
假设2:空气将溶液中的I-氧化为I2,c(I2)增大。补全该反应的离子方程式。
4I-+O2+___________ =I2+___________
(5)设计并进行实验。
①证明假设1成立的实验现象是___________ 。
②实验6证明假设2不成立,其实验操作是___________ 。该实验中,20min后溶液不变蓝的原因可能是___________ (写出一条即可)。
Ⅰ.室温下进行下表所列实验。
| 序号 | 实验操作 | 实验现象 |
| 实验1 | 向5mL0.1mol·L-1KI溶液中,加入5滴0.1mol·L-1FeCl3溶液(混合溶液pH=5) | 溶液变为棕黄色(标记为溶液a) |
| 实验2 | 取1mL溶液a,加入___________ | ___________ |
| 实验3 | 取1mL溶液a,滴加2滴0.1mol·L-1KSCN溶液 | 溶液变红 |
(1)实验2证明实验1中有I2生成,加入的试剂是
(2)上述实验可以证明Fe3+与I-发生可逆反应,原因是
(3)实验1中Fe3+与I-反应的离子方程式为
Ⅱ.20min后,观察到实验1所得溶液棕黄色变深(标记为溶液b)。小组同学继续对溶液颜色变化的原因进行探究。
查阅资料:i.I-+I2
ii.在酸性较强的条件下,I-可被空气氧化为I2.
(4)提出假设:
假设1:溶液中生成了
假设2:空气将溶液中的I-氧化为I2,c(I2)增大。补全该反应的离子方程式。
4I-+O2+
(5)设计并进行实验。
| 序号 | 实验操作 | 实验现象 |
| 实验4 | 取1mL与溶液b颜色相近的碘水,加入1mLCCl4,振荡后静置 | 水层几近无色 |
| 实验5 | 取1mL溶液b,加入1mLCCl4,振荡相同时间后静置 | 水层显浅黄色 |
| 实验6 | ___________ | 20min后溶液不变蓝 |
②实验6证明假设2不成立,其实验操作是
某兴趣小组对 与
与 的反应进行探究。
的反应进行探究。
I.室温下进行下表所列实验:
(1)实验2证明实验1中有 生成,加入的试剂是
生成,加入的试剂是___________ 。
(2)上述实验可以证明 与
与 发生了可逆反应,原因是
发生了可逆反应,原因是___________ 。
(3)实验1中 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
Ⅱ. 后,观察到实验1所得溶液棕黄色变深(标记为溶液b)。小组同学继续对溶液颜色变化的原因进行探究。
后,观察到实验1所得溶液棕黄色变深(标记为溶液b)。小组同学继续对溶液颜色变化的原因进行探究。
查阅资料:i. 呈棕褐色,
呈棕褐色, 均难溶于
均难溶于 。
。
ii.在酸性较强的条件下, 可被空气中的氧气氧化为
可被空气中的氧气氧化为 。
。
(4)提出假设
假设一:溶液中生成了___________ 。
假设二:空气将溶液中的 氧化为
氧化为 ,使
,使 增大。
增大。
酸性条件下空气氧化 的离子方程式为:
的离子方程式为:___________ 。
(5)设计并进行实验
①证明假设1成立的实验现象是___________ 。
②实验6证明假设2不成立,其实验操作是___________ 。该实验中, 后溶液不变蓝的原因可能是
后溶液不变蓝的原因可能是___________ (写出一条即可)。
I.室温下进行下表所列实验:
| 序号 | 实验操作 | 实验现象 |
| 实验1 | 向 | 溶液变为棕黄色(标记为溶液a) |
| 实验2 | 取 | ___________ |
| 实验3 | 取 | 溶液变红 |
(1)实验2证明实验1中有
(2)上述实验可以证明
(3)实验1中
Ⅱ.
查阅资料:i.
ii.在酸性较强的条件下,
(4)提出假设
假设一:溶液中生成了
假设二:空气将溶液中的
酸性条件下空气氧化
(5)设计并进行实验
| 序号 | 实验操作 | 实验现象 |
| 实验4 | 取 | 水层几近无色 |
| 实验5 | 取 | 水层显浅黄色 |
| 实验6 | ___________ |
②实验6证明假设2不成立,其实验操作是
某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。

I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
(1)研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为_____________ 。
(2)实验2中,加入石蜡油的目的是_________________________ 。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是___ 。
II.查阅资料,继续探究
【资料】AgSCN为不溶于水的白色固体。
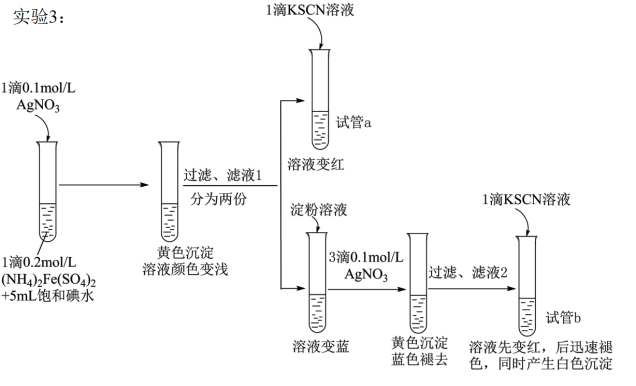
(4)试管a的实验现象说明滤液l中含有_____________ 。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是_______________________ 。
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:
i.可能是AgNO3氧化了Fe2+;
ii.可能是空气中的O2氧化了Fe2+。
他设计、实施了实验4,实验记录如下表。
①试剂a是 ___________ 。
②依据实验4,甲同学做出判断:______________________
(7)根据实验1~4所得结论是___________________________________ 。

I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
| 编号 | 饱和 (NH4)2Fe(SO4)2溶液 | 饱和磺水 | 石蜡油 | 操作 | KSCN溶液 | 现象 |
| 2-1 | 1滴 | 5mL | 1mL | 不加热 | 1滴 | 无明显现象 |
| 2-2 | 1滴 | 5mL | 1mL | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(2)实验2中,加入石蜡油的目的是
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是
II.查阅资料,继续探究
【资料】AgSCN为不溶于水的白色固体。

(4)试管a的实验现象说明滤液l中含有
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:
i.可能是AgNO3氧化了Fe2+;
ii.可能是空气中的O2氧化了Fe2+。
他设计、实施了实验4,实验记录如下表。
| 编号 | 实验操作 | 实验现象 |
| 4 | 在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水, 1滴试剂a,一段时间后加入1滴KSCN溶液 | 溶液不变红 |
②依据实验4,甲同学做出判断:
(7)根据实验1~4所得结论是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


