解答题-结构与性质 适中0.65 引用1 组卷233
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________ ,3d能级上的未成对电子数为_________ ,能量最高能级的电子云形状为_________ 。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________ ,写出一个与SCN-具有相同空间构型的分子:_________ 。
(3)氮元素的最简单氢化物为氨,氨的沸点_________ (填“高于”或“低于”)膦(PH3),原因是_________ 。氮元素另一种氢化物联氨(N2H4)是_________ (填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________ 。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________ 。
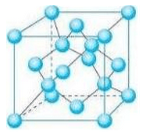
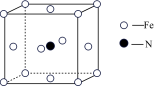
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________ 。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________ g/cm3(设阿伏伽德罗常数的值为NA)。
(1)铁元素基态原子的电子排布式为
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为
(3)氮元素的最简单氢化物为氨,氨的沸点
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:

2019·江西萍乡·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网