解答题-工业流程题 较难0.4 引用1 组卷358
某工业废催化剂含有 SiO2、ZnO、CuS、ZnS、Fe3O4 等物质,为落实“节约资源,变 废为宝”的环保理念,某课外兴趣小组的同学取 20g 该物质进行实验,回收其中的 Cu 和 Zn,实验方案如下:

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是______ 溶液。

(2)滤液Ⅰ中的 Fe2+最好用______ 来检验。
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是______ (填元素符号),由滤液Ⅱ、Ⅳ滤液获得 ZnSO4•7H2O 的操作是______________ 。
(4)第二次浸出时的化学方程式为_______________ 。
(5)加 A 调节溶液的 pH 约为______ 时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________ 。

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是

(2)滤液Ⅰ中的 Fe2+最好用
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是
(4)第二次浸出时的化学方程式为
(5)加 A 调节溶液的 pH 约为
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是
2019·湖南株洲·一模
类题推荐
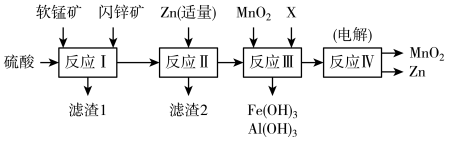
一水合硫酸锰(MnSO4·H2O)主要用于饲料添加剂和植物合成叶绿素的催化剂。一种以软锰矿(主要成分是MnO2,还有CaO、MgO、Al2O3、SiO2等杂质)和废铁屑(主要成分是Fe,还含有少量Cu)为原料制备MnSO4·H2O的工艺流程如下:
回答下列问题:
(1)滤渣I与NaOH溶液反应的离子方程式为___________ 。
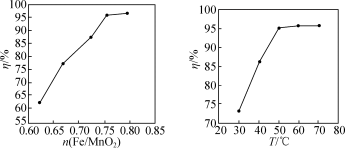
(2)“浸出”时,锰的浸出率随Fe/MnO2摩尔比、反应温度的变化曲线如下图所示,则最佳的反应条件为___________ 。
①Fe、稀硫酸、MnO2发生总反应的离子方程式为___________ 。
②反应过程中硫酸不能过量太多的原因是___________ 。
(4)“氧化”时,过氧化氢的实际消耗量大于理论消耗量的原因是___________ 。
(5)“除铁、铝”调节溶液的pH不小于___________ (保留1位小数;已知离子浓度小于1.0×10-5 mol·L-1时,可认为该离子沉淀完全)。
(6)滤渣Ⅳ的主要成分是___________ (填化学式)。
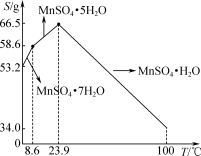
(7)硫酸锰在不同温度下的溶解度和一定温度范围内析出晶体的组成如图所示,“除杂”所得滤液控制温度在80~90 ℃之间蒸发结晶,___________ (填操作名称),得到MnSO4·H2O。

| 物质 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| Ksp | 1.0×10-33 | 5×10-17 | 1.0×10-38 | 2.0×10-13 |
(1)滤渣I与NaOH溶液反应的离子方程式为
(2)“浸出”时,锰的浸出率随Fe/MnO2摩尔比、反应温度的变化曲线如下图所示,则最佳的反应条件为
| 离子 | Mn2+ | Fe2+ | Fe3+ | Cu2+ | H+ |
| c/(mol·L-1) | 0.601 | 0.15 | 0.3 | 0.001 | 0.1 |
②反应过程中硫酸不能过量太多的原因是
(4)“氧化”时,过氧化氢的实际消耗量大于理论消耗量的原因是
(5)“除铁、铝”调节溶液的pH不小于
(6)滤渣Ⅳ的主要成分是
(7)硫酸锰在不同温度下的溶解度和一定温度范围内析出晶体的组成如图所示,“除杂”所得滤液控制温度在80~90 ℃之间蒸发结晶,
工业上以锌矿(主要成分为ZnS,还含有FeO、Fe2O3、CuS、NiS、SiO2等杂质)为主要原料制备皓矾(ZnSO4• 7H2O)的工艺流程如图。回答下列问题:
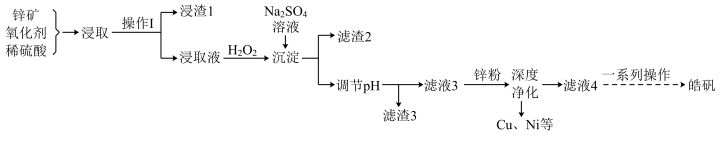
(1)“浸取”之前,需要对锌矿进行粉碎处理,其目的是_________________ 。
(2)“浸取”时,需要加入氧化剂FeCl3溶液,写出氯化铁溶液与硫化锌反应的离子方程式:______________ ,“浸取”时,溶液为酸性介质条件下,可能造成的影响是__________________ 。
(3)“浸取液”中加入H2O2的目的是_____________________ 。
(4)加入H2O2反应完成后,加入硫酸钠溶液,可使溶液中的铁元素形成黄钠铁矶沉淀[NaFe3(SO 4)2(OH)6],写出生成黄钠铁矾的化学方程式:______________ 。
(5)为了检验“滤液3”中铁元素是否除尽,可分别取滤液3于试管中,加入KSCN溶液和K3[Fe(CN)6]溶液进行检验,若检验出有Fe2+,则可观察到加入了K3[Fe(CN)6]的试管中的现象为____________ ,解释产生此现象的原因:____________________ (用离子方程式表示)。
(6)“滤液4”经“一系列操作”可得产品皓矾(ZnSO4 • 7H2O),具体操作为___________ 、_____ 、过滤、洗涤、干燥。
(7)工艺中产生的废液中含有Zn2+,排放前需处理。向废液中加入由CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S ZnS(s)+2H+。处理后的废液中部分微粒浓度如下:
ZnS(s)+2H+。处理后的废液中部分微粒浓度如下:
则处理后的废液中c(Zn2+)=_____ mol • L-1 [已知:Ksp(ZnS)=l.0 10-23,Ka1(H2S)=1.0
10-23,Ka1(H2S)=1.0 10-7,Ka2(H2S)=1.0
10-7,Ka2(H2S)=1.0 10-l4,Ka(CH3COOH) = 2.0
10-l4,Ka(CH3COOH) = 2.0 10-5]
10-5]

(1)“浸取”之前,需要对锌矿进行粉碎处理,其目的是
(2)“浸取”时,需要加入氧化剂FeCl3溶液,写出氯化铁溶液与硫化锌反应的离子方程式:
(3)“浸取液”中加入H2O2的目的是
(4)加入H2O2反应完成后,加入硫酸钠溶液,可使溶液中的铁元素形成黄钠铁矶沉淀[NaFe3(SO 4)2(OH)6],写出生成黄钠铁矾的化学方程式:
(5)为了检验“滤液3”中铁元素是否除尽,可分别取滤液3于试管中,加入KSCN溶液和K3[Fe(CN)6]溶液进行检验,若检验出有Fe2+,则可观察到加入了K3[Fe(CN)6]的试管中的现象为
(6)“滤液4”经“一系列操作”可得产品皓矾(ZnSO4 • 7H2O),具体操作为
(7)工艺中产生的废液中含有Zn2+,排放前需处理。向废液中加入由CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S
| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度/(mol • L-1) | 0.20 | 0.10 | 0.20 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网