解答题-原理综合题 适中0.65 引用1 组卷372
氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。
回答下列问题
(1)催化转化器可使汽车尾气反应而转化:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1
△H=___________ kJ·mol-1(用含a、b、c的代数式表示)
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=___________ 。
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是___________ ;
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
③已知汽车尾气转化反应的△H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是___________ 。(填序号)

(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)0.5(k为速率常数)。下列表述正确的是___________ (填标号)。
A.N2O分解反应中,k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___________ mol·L-1(用精确值表示)
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO和N2。已知,采用碳还原法处理某工厂氮氧化物废气时,生成的CO与N2的物质的量之比为4︰3。则该工厂尾气中NO和NO2的物质的量比为___________ 。
回答下列问题
(1)催化转化器可使汽车尾气反应而转化:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H已知:N2(g)+O2(g)==2NO(g) △H1= a kJ·mol-1
2C(s)+O2(g)==2CO(g) △H2= b kJ·mol-1
C(s)+ O2(g)=CO2(g) △H3= c kJ·mol-1
△H=
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。

①T℃时,该化学反应的平衡常数K=
②下列事实无法判断汽车尾气转化反应达到到化学平衡状态的是
A.NO消耗速率等于N2消耗速率的2倍 B.混合气体平均相对分子质量不再变化
C.体系中NO的转化率和CO的转化率相等 D.气体的密度不再变化
③已知汽车尾气转化反应的△H<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系正确的是

(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)
 2I(g)(快反应)
2I(g)(快反应)第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)0.5(k为速率常数)。下列表述正确的是
A.N2O分解反应中,k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO和N2。已知,采用碳还原法处理某工厂氮氧化物废气时,生成的CO与N2的物质的量之比为4︰3。则该工厂尾气中NO和NO2的物质的量比为
2019·福建龙岩·一模
类题推荐
烟道气和汽车尾气(氮氧化物、NH3等)是造成雾霾天气污染的原因之一,研究这些排放气的处理是化学工作者研究的重要课题。
(1)已知反应2N2O(g)=2N2(g)+O2(g)的△H=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为_______ kJ。
(2)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下表所示:
①在0~20min时段,反应速率v(N2O)量为___________ mol·L-1·min-1。
②若N2O起始浓度c0为0.100mol/L,则反应至30min时N2O的转化率α=_________ 。
③下图中的半衰期指任一浓度N2O消耗一半时所需的相应时间。当温度为T1、起始压强为p0、反应至1min时,体系压强p=_______ (用p0表示)。
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是______ (填字母代号)。
A.第一步对总反应速率起决定作用
B.第二步活化能比第三步大
C.N2O分解反应中,k(含碘)>k(无碘)
D.I2浓度与N2O分解速率无关
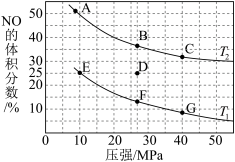
(4)已知2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-744kJ/mol,为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10molCO和8molNO发生反应,如图所示为平衡时NO的体积分数与温度、压强的关系。
2CO2(g)+N2(g) △H=-744kJ/mol,为研究汽车尾气转化为无毒无害物质的有关反应,在密闭容器中充入10molCO和8molNO发生反应,如图所示为平衡时NO的体积分数与温度、压强的关系。
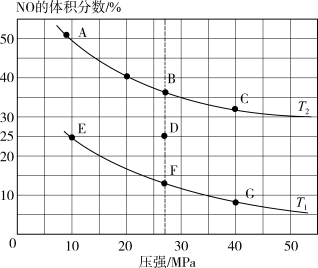
①该反应达到平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施有______ (填字母代号)。
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
②压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,容器的体积为4L,计算该温度下平衡常数Kp=_______ (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的_________ 点。
(1)已知反应2N2O(g)=2N2(g)+O2(g)的△H=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为
(2)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下表所示:
| 反应时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| C(N2O)/mol·L-1 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~20min时段,反应速率v(N2O)量为
②若N2O起始浓度c0为0.100mol/L,则反应至30min时N2O的转化率α=
③下图中的半衰期指任一浓度N2O消耗一半时所需的相应时间。当温度为T1、起始压强为p0、反应至1min时,体系压强p=
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是
A.第一步对总反应速率起决定作用
B.第二步活化能比第三步大
C.N2O分解反应中,k(含碘)>k(无碘)
D.I2浓度与N2O分解速率无关
(4)已知2NO(g)+2CO(g)

①该反应达到平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施有
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
②压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,容器的体积为4L,计算该温度下平衡常数Kp=
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网