解答题-原理综合题 适中0.65 引用1 组卷361
I. 氢气是一种常用的化工原料,应用十分广泛。
(1)以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+1/2CO2(g)===1/2NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________ 。
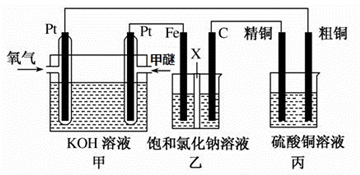
II.某同学设计了一组电化学装置如下图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。
根据要求回答相关问题:
(2)写出装置甲中负极的电极反应式:_______________________________________ 。
(3)装置乙中石墨电极(C)的电极反应式为:_________________________________ 。
(4)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积___________ L(标况下);装置乙中溶液的pH为___________ (溶液体积为200mL不变),要使乙烧杯中的溶液恢复到原来的状态,需要加入的物质是___________ 。
(1)以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g) ΔH1=-92.4 kJ·mol-1
②NH3(g)+1/2CO2(g)===1/2NH2CO2NH4(s) ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l) ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为
II.某同学设计了一组电化学装置如下图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。

根据要求回答相关问题:
(2)写出装置甲中负极的电极反应式:
(3)装置乙中石墨电极(C)的电极反应式为:
(4)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积
18-19高二上·福建福州·期末
类题推荐
甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。
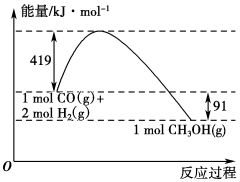
②
③CO(g)+1/2O2(g)=CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)=H2O(l) ΔH=-284 kJ/mol
H2O(l)=H2O(g) ΔH=+44 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_______________________ 。
(2)H—O键的键能x为________ kJ/mol。
(3)在____ (填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
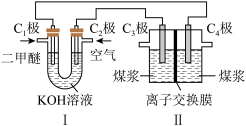
(4)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。
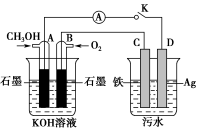
甲 乙
①写出甲池的A极电极反应式:__________________________ 。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的________ 。
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
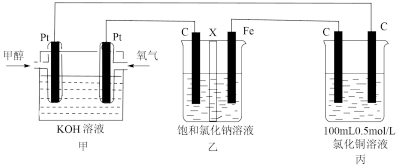
(5)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
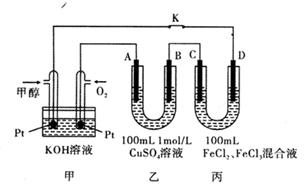
①乙中A极析出的气体在标准状况下的体积为____ 。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是__________ 离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要__________ mL 5.0 mol/L NaOH溶液。

CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。已知①常压下反应的能量变化如图所示。

②
| 化学键 | H—H | H—O | O=O |
| 键能kJ/mol | 436 | x | 496 |
③CO(g)+1/2O2(g)=CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)=H2O(l) ΔH=-284 kJ/mol
H2O(l)=H2O(g) ΔH=+44 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式
(2)H—O键的键能x为
(3)在
(4)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。

甲 乙
①写出甲池的A极电极反应式:
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
(5)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①乙中A极析出的气体在标准状况下的体积为
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网