解答题-原理综合题 适中0.65 引用1 组卷491
已知:用NH3催化还原NOx时包含以下反应。
反应①:4NH3(g) + 6NO(g) 5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1
5N2(g) + 6H2O(l) ∆H1 = -1807.0kJ•mol-1
反应②:4NH3(g) + 6NO2(g) ⇌ 5N2(g) + 3O2(g) + 6H2O(l) ∆H2 = ?
反应③:2NO(g) + O2(g) ⇌2NO2(g) ∆H3 = -113.0kJ•mol-1
(1)反应②的∆H2 =_________________________ 。 反应①②在热力学上趋势大,其原因是___________________________________________________________________ 。
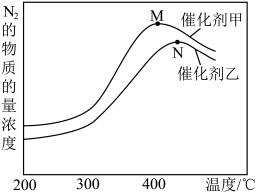
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。
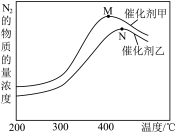
①反应①的平衡常数的表达式K=__________ 。在催化剂甲的作用下反应的平衡常数_______________ 在催化剂乙的作用下反应的平衡常数(填写“大于”,“小于”或“等于”)。
②N点后N2浓度减小的原因可能是_________________ 、 ________________ 。
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率_______________ % ,达平衡所用时间为5分钟,则用NO表示此反应平均反应速率为__________________ 。
反应①:4NH3(g) + 6NO(g)
反应②:4NH3(g) + 6NO2(g) ⇌ 5N2(g) + 3O2(g) + 6H2O(l) ∆H2 = ?
反应③:2NO(g) + O2(g) ⇌2NO2(g) ∆H3 = -113.0kJ•mol-1
(1)反应②的∆H2 =
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。

①反应①的平衡常数的表达式K=
②N点后N2浓度减小的原因可能是
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率
2019·重庆·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网