填空题 适中0.65 引用1 组卷252
天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______ 。
②有利于提高混合气中CH4含量的措施是:_______ 。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
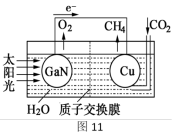
(2)甲烷可制成燃料电池,其装置如下图所示。
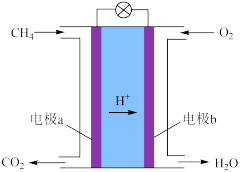
①电极b是_______ 极(填“正”或“负”)。
②a极的电极反应式是_______________ 。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:
②有利于提高混合气中CH4含量的措施是:
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是
②a极的电极反应式是
19-20高三上·北京昌平·期末
类题推荐
I.合成氨的原料气由天然气与水蒸气和空气高温反应而得。涉及的主要反应如下:
(a)CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
(b)2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=? kJ/mol
(c)CO(g)+H2O(g)=H2(g)+CO2(g) ΔH3=-41.2 kJ/mol
下表给出了一系列常见化学键的键能(单位:kJ/mol):
(1)写出1 mol甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:_______ (利用键能数据估算该反应焓变)。
(2)根据(1)的计算结果和已知数据,计算可得:ΔH2=_______ kJ/mol。
(3)在一定条件下,在容积恒定为V L的密闭容器中充入a mol CO与2a mol H2在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH4=x kJ/mol。CO转化率与温度、压强的关系如图所示:
CH3OH(g) ΔH4=x kJ/mol。CO转化率与温度、压强的关系如图所示:
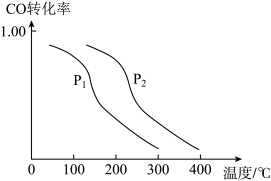
①由图可知:x_______ 0(选填“>”“<”或“=”),P1_______ P2(选填“>”“<”或“=”)。
②下列措施中能够同时满足增大正反应速率和提高CO转化率的是:_______ (选填序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将甲醇从体系混合物中分离出来
II.工业上利用合适的催化剂可以直接将CO2转化为乙酸,不同温度下,催化剂的催化效率与乙酸的生成速率的关系如图所示
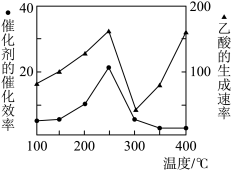
(4)温度在250℃到300℃时,乙酸的生成速率降低的原因可是_______
(5)温度超过300度时,催化剂的催化效率大大降低,但是乙酸的生成速率反而继续上升,出现这种现象的原因可能是_______
(a)CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
(b)2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=? kJ/mol
(c)CO(g)+H2O(g)=H2(g)+CO2(g) ΔH3=-41.2 kJ/mol
下表给出了一系列常见化学键的键能(单位:kJ/mol):
| 化学键 | C-H | O=O | C=O | O-H |
| 键能 | 412 | 497 | 799 | 463 |
(1)写出1 mol甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:
(2)根据(1)的计算结果和已知数据,计算可得:ΔH2=
(3)在一定条件下,在容积恒定为V L的密闭容器中充入a mol CO与2a mol H2在催化剂作用下合成甲醇:CO(g)+2H2(g)

①由图可知:x
②下列措施中能够同时满足增大正反应速率和提高CO转化率的是:
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将甲醇从体系混合物中分离出来
II.工业上利用合适的催化剂可以直接将CO2转化为乙酸,不同温度下,催化剂的催化效率与乙酸的生成速率的关系如图所示

(4)温度在250℃到300℃时,乙酸的生成速率降低的原因可是
(5)温度超过300度时,催化剂的催化效率大大降低,但是乙酸的生成速率反而继续上升,出现这种现象的原因可能是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2CO2(g)
2CO2(g) CH3OH(g)
CH3OH(g)