填空题 适中0.65 引用1 组卷345
工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) CH3OH(1)△H=xkJ/mol
CH3OH(1)△H=xkJ/mol
(1)已知常温下CH3OH(1)、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________ ;为提高合成甲醇反应的选择性,关键因素是___________ 。
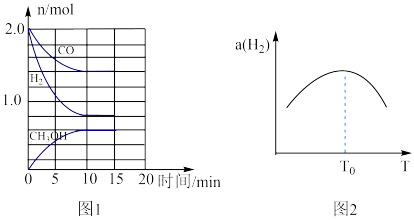
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) CH3OH(g)△H<0,相关数据如图。
CH3OH(g)△H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________ mol/(L·min);M和N点的逆反应速率较大的是___________ (填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________ 。
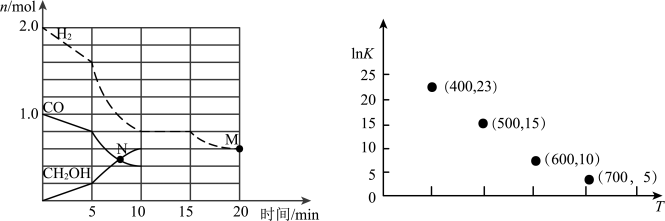
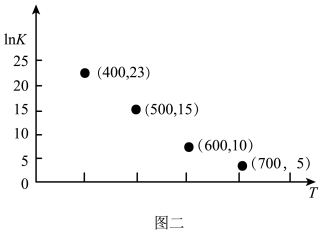
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________ (写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________ 。
CO(g)+2H2(g)
(1)已知常温下CH3OH(1)、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g)
①该反应0~10min的平均速率υ(H2)
②10min时容器内CO的体积分数为

③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=
2019·陕西西安·一模
类题推荐
H2是一种重要的清洁能源。回答下列问题:
(1)已知:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)∆H1=-49.0kJ mol-1
mol-1
CO(g)+H2O⇌CO2(g)+H2(g)∆H2=-41.1kJ mol-1
mol-1
则H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g),∆H=_______
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g),实验测得平衡时CO的转化率(a)随温度、压强的变化如图所示:

①p1_______ p2,判断依据是_______
②比较:M点的正反应速率_______ N点的逆反应速率。(填“>”、“<”或“=”)
(3)在温度不变且容积为1L的密闭容器中发生反应CO(g)+2H2(g)⇌CH3OH(g),测得各物质的物质的量随时间变化如表所示:
①下列各项能作为判断该反应达到平衡标志的是_______ (填字母)。
A.容器内压强保持不变
B.2v正(H2)=v逆(CH3OH)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,则在该温度下此反应的平衡常数Kp=_______ (kPa)-2。(用平衡分压代替平衡浓度计算,分压=总压物质的量分数)
③若用单位时间内分压的变化表示反应速率,则0~10min内平均反应速率v(H2)=_______ kpa·min-1
(1)已知:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)∆H1=-49.0kJ
CO(g)+H2O⇌CO2(g)+H2(g)∆H2=-41.1kJ
则H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g),∆H=
(2)恒温恒压下,在容积可变的密闭容器中加入一定量的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g),实验测得平衡时CO的转化率(a)随温度、压强的变化如图所示:

①p1
②比较:M点的正反应速率
(3)在温度不变且容积为1L的密闭容器中发生反应CO(g)+2H2(g)⇌CH3OH(g),测得各物质的物质的量随时间变化如表所示:
| 时间/min | 0 | 5 | 10 | 5 |
| n(H2)/mol | 4 | 2.6 | 2 | |
| n(CO)/mol | 2 | 1.3 | 1 | 1 |
| n (CH3OH)/mol | 0 | 0.7 | 1 |
①下列各项能作为判断该反应达到平衡标志的是
A.容器内压强保持不变
B.2v正(H2)=v逆(CH3OH)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,则在该温度下此反应的平衡常数Kp=
③若用单位时间内分压的变化表示反应速率,则0~10min内平均反应速率v(H2)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(l)
CH3OH(l)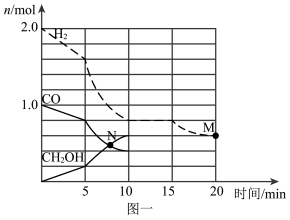
 CH3OH(g)
CH3OH(g)