解答题-原理综合题 适中0.65 引用4 组卷996
I.已知:①NaHCO3(s)=Na+(ag)+HCO (aq)△H1=+18.81kJ·mol-1
(aq)△H1=+18.81kJ·mol-1
②Na2CO3(s)=2Na+(aq)+CO (aq)△H2=-16.44 k J· mol-1
(aq)△H2=-16.44 k J· mol-1
③2NaHCO3(s)=Na2CO3(s)+CO2(g)+H2O(1)△H3=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________ 。
(2)NaHCO3溶液中主要存在2种化学平衡:a.HCO +H2O ⇌H2CO3+OH-,b.2HCO
+H2O ⇌H2CO3+OH-,b.2HCO ⇌CO
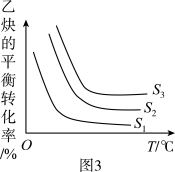
⇌CO +H2O+CO2。根据理论计算0.10 mol·.L-1NaHCO3溶液中2个反应的转化率随温度变化如图1所示(不考虑相互影响):
+H2O+CO2。根据理论计算0.10 mol·.L-1NaHCO3溶液中2个反应的转化率随温度变化如图1所示(不考虑相互影响):
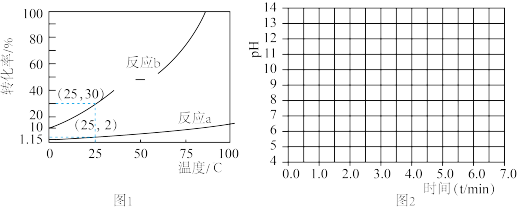
①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为__________ mol·L-1。①
②加热蒸干NaHCO3溶液最后得到的固体是___________ 。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
请在图2中作出NaHCO3溶液pH随时间变化曲线_________________
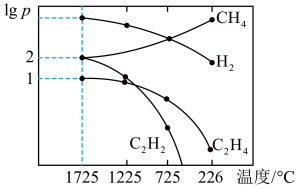
II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图
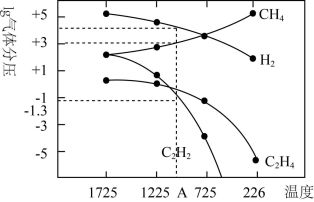
(3)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4),CH4的平衡转化率为
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4),CH4的平衡转化率为___________ ;上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,且平衡时,c (CH4)=2c(C2H4),则t=___________ s;
(4)列式计算反应2CH4(g) C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________ (用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(5)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________ 。
②Na2CO3(s)=2Na+(aq)+CO
③2NaHCO3(s)=Na2CO3(s)+CO2(g)+H2O(1)△H3=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因
(2)NaHCO3溶液中主要存在2种化学平衡:a.HCO

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为
②加热蒸干NaHCO3溶液最后得到的固体是
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mol·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(3)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)
(4)列式计算反应2CH4(g)
(5)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有
2019·湖北·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 C2H2(g)+3H2(g)的△H=
C2H2(g)+3H2(g)的△H=