解答题-实验探究题 适中0.65 引用3 组卷505
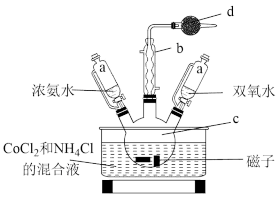
超顺磁性的Fe3O4粒子(粒子平均直径为25nm)在医疗上有重要作用,实验室制备方法如下:在有N2保护和剧烈搅拌条件下,向FeCl3、FeCl2混合溶液中滴加氨水,可得到黑色的Fe3O4。实验装置如图:
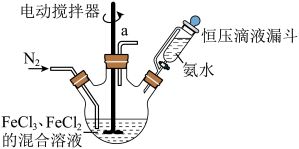
请回答下列问题:
(1)恒压滴液漏斗的优点是______________________ 。
(2)充N2的目的是___________ ,反应温度应控制在50℃,加热方法为___________ 。
(3)制备超顺磁性Fe3O4粒子反应原理的离子方程式为______________________ 。
(4)充分反应后,将三颈烧瓶中的混合物通过离心分离,然后水洗,最后用无水乙醇洗涤,用无水乙醇洗涤的优点是___________ ;为了验证得到的固体是超顺磁性的Fe3O4粒子,实验操作:_______________ 。为了检验超顺磁性粒子中含有+2价的铁,需要的化学试剂为___________ (填代号)。
A.KSCN溶液 B.HCl溶液 C.H2O2溶液 D.K3[Fe(CN)6]溶液
(5)实验制得的超顺磁性的Fe3O4粒子中含有少量的Fe(OH)3,为测得Fe3O4的含量,称取mg试样,放在小烧杯中用足量稀硫酸溶解后定容于100mL容量瓶中,准确量取其中的20.00mL溶液置于锥形瓶中,然后用cmol/L的KMnO4溶液进行滴定,当______________________ 停止滴定,然后重复二次滴定,平均消耗KMnO4溶液ⅴmL,该样品的纯度为___________ 。(已知MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O)

请回答下列问题:
(1)恒压滴液漏斗的优点是
(2)充N2的目的是
(3)制备超顺磁性Fe3O4粒子反应原理的离子方程式为
(4)充分反应后,将三颈烧瓶中的混合物通过离心分离,然后水洗,最后用无水乙醇洗涤,用无水乙醇洗涤的优点是
A.KSCN溶液 B.HCl溶液 C.H2O2溶液 D.K3[Fe(CN)6]溶液
(5)实验制得的超顺磁性的Fe3O4粒子中含有少量的Fe(OH)3,为测得Fe3O4的含量,称取mg试样,放在小烧杯中用足量稀硫酸溶解后定容于100mL容量瓶中,准确量取其中的20.00mL溶液置于锥形瓶中,然后用cmol/L的KMnO4溶液进行滴定,当
2019·江西抚州·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网