解答题-工业流程题 适中0.65 引用1 组卷150
汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
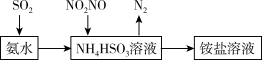
①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=__________ mol/L(填确值)
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_____________________ 。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g) 2CO2(g) △H3
2CO2(g) △H3
则2H2O(g)+4NO(g)+3O2(g) 4HNO3(g) △H4=
4HNO3(g) △H4=______________________ 。
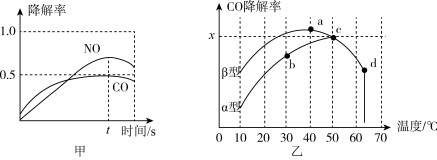
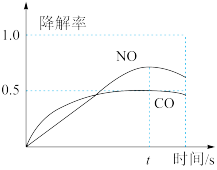
②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因______________________ 。
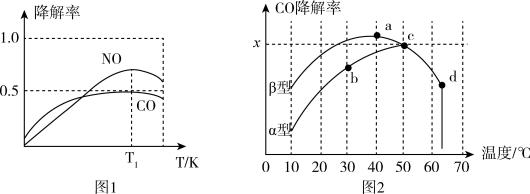
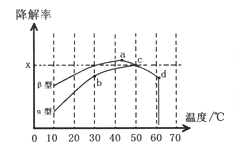
(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________________________________ 。(用含x的代数式表示)
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“ ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式____________________________________________ 。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。

①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g)
 2CO2(g) △H3
2CO2(g) △H3则2H2O(g)+4NO(g)+3O2(g)
 4HNO3(g) △H4=
4HNO3(g) △H4=②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因

(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“
 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式
19-20高三上·安徽·期末
类题推荐
I.某学习小组利用铁与稀硫酸的反应,探究影响化学反应速率的因素,结果如表:
(1)实验1、2表明_______ 对反应速率有影响。
(2)探究反应物浓度影响反应速率的实验有_______ (填实验序号)。
(3)该小组的实验中,探究的反应速率的影响因素还有_______ ,体现该影响因素的实验有_______ (填实验序号)。
II汽车尾气的主要成分有CO、SO2、NO、NO2等。
(4)利用氨水可以将SO2、NO2吸收,原理如下图所示:
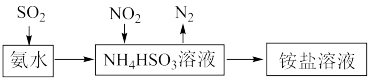
请写出NO2被吸收反应的离子方程式_______ 。
(5)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:
反应Ⅰ:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ·mol-1
反应Ⅱ:2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ·mol-1
反应Ⅲ:3NO2(g)+H2O(g)=2HNO3+NO(g) ΔH3=-138.0kJ·mol-1
则反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4=_______ 。
②已知TiO2催化尾气降解原理可表示为:
2CO(g)+O2(g) 2CO2(g) ΔH5;
2CO2(g) ΔH5;
2H2O(g)+4NO(g)+3O2(g) 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如下图所示。请解释ts后NO降解率下降的可能原因_______ 。
| 实验序号 | 铁的质量(g) | 铁的形态 | V(H2SO4) | c(H2SO4)(mol/L) | 反应前溶液的温度(℃) | 金属完全消失的时间(s) |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
(1)实验1、2表明
(2)探究反应物浓度影响反应速率的实验有
(3)该小组的实验中,探究的反应速率的影响因素还有
II汽车尾气的主要成分有CO、SO2、NO、NO2等。
(4)利用氨水可以将SO2、NO2吸收,原理如下图所示:
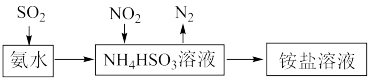
请写出NO2被吸收反应的离子方程式
(5)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:
反应Ⅰ:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ·mol-1
反应Ⅱ:2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ·mol-1
反应Ⅲ:3NO2(g)+H2O(g)=2HNO3+NO(g) ΔH3=-138.0kJ·mol-1
则反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4=
②已知TiO2催化尾气降解原理可表示为:
2CO(g)+O2(g)
2H2O(g)+4NO(g)+3O2(g)
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如下图所示。请解释ts后NO降解率下降的可能原因

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2CO2(g);
2CO2(g);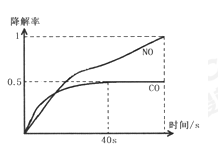
 )。
)。