解答题-工业流程题 适中0.65 引用1 组卷630
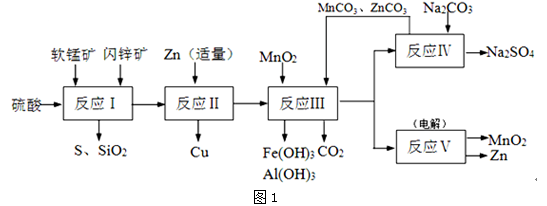
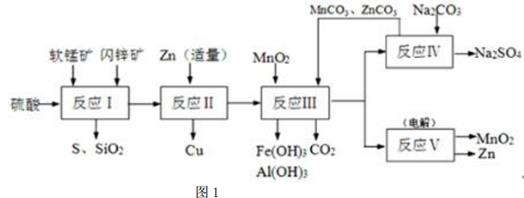
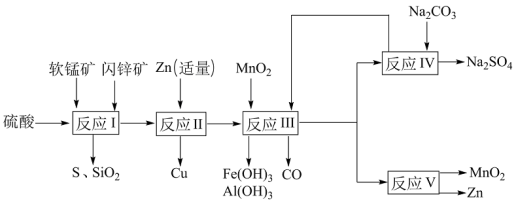
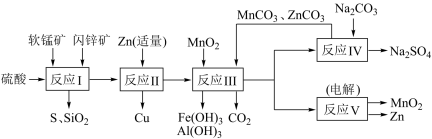
锌锰干电池是很古老的一次性电池,它的生产原料主要有软锰矿和闪锌矿。已知闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分;软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分。科研人员开发了综合利用软锰矿和闪锌矿的同槽酸浸工艺,工艺流程如下图所示。
请回答下列问题:
(1)反应I需不断搅拌,目的是____________________________ 。
(2)检验反应I的滤液中含有Fe3+的试剂为____________ ;写出反应I中由FeS生成Fe3+的离子方程式____________________________________ 。
(3)反应Ⅱ加入适量锌的作用是__________________ ;反应III中MnO2的作用是________________ 。
(4)已知ZnCO3、MnCO3的Ksp分别为1.4×10-10、2.2×10-11;要使反应IV之后的溶液中Zn2+、Mn2+浓度均降到1.0×10-6mol/L,则溶液中残留的CO32-浓度至少为__________ mol/L。
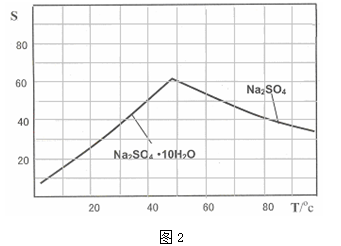
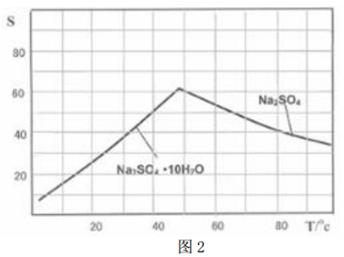
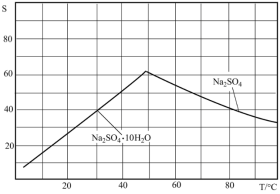
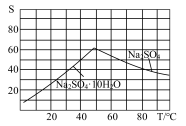
(5)图是Na2SO4和Na2SO4•10H2O的溶解 度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液________ →__________ → 用乙醇洗涤→干燥。用乙醇洗涤而不用水洗的原因是_________________________________________ 。

请回答下列问题:
(1)反应I需不断搅拌,目的是
(2)检验反应I的滤液中含有Fe3+的试剂为
(3)反应Ⅱ加入适量锌的作用是
(4)已知ZnCO3、MnCO3的Ksp分别为1.4×10-10、2.2×10-11;要使反应IV之后的溶液中Zn2+、Mn2+浓度均降到1.0×10-6mol/L,则溶液中残留的CO32-浓度至少为
(5)图是Na2SO4和Na2SO4•10H2O的溶解 度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液

2018·广东韶关·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网