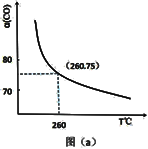
解答题-原理综合题 适中0.65 引用1 组卷45
CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25 ℃,1.01105Pa下测定):
①CO2(g) + 3H2(g) ⇌CH3OH(l) + H2O(l) ΔH =-49.01 kJ·mol-1
②2CH3OH(l)⇌CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)⇌CO2(g) + H2(g) ΔH = -41.17 kJ·mol-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为_______ 。
(2)反应①的平衡常数表达式K=_______ 。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是_______ (填字母)。
A.容器内气体相对分子质量保持不变 B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍 D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如图:
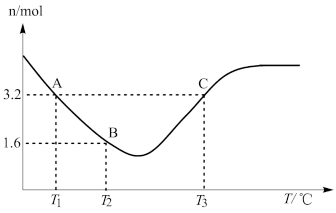
I.A、C两点的速率大小v(A)_______ (填“大于”“小于”“等于”或“无 法判断”)v(C)。
II.请解释曲线中CO的物质的量先减小后增大的原因_______ 。
①CO2(g) + 3H2(g) ⇌CH3OH(l) + H2O(l) ΔH =-49.01 kJ·mol-1
②2CH3OH(l)⇌CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)⇌CO2(g) + H2(g) ΔH = -41.17 kJ·mol-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为
(2)反应①的平衡常数表达式K=
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是
A.容器内气体相对分子质量保持不变 B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍 D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如图:

I.A、C两点的速率大小v(A)
II.请解释曲线中CO的物质的量先减小后增大的原因
18-19高二上·湖北随州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OH(l) + H2O(l)
CH3OH(l) + H2O(l)