解答题-原理综合题 适中0.65 引用1 组卷263
NOx是大气污染物,但只要合理利用也是重要的资源。回答列问题:
(1)将NO2和水蒸气混合,反应的现象为_________ ,写出该反应的化学方程式_________ 。
(2)2NO(g)+O2(g) 2NO2(g)的历程分两步,反应方程式、速率方程和吸放热情况如下:
2NO2(g)的历程分两步,反应方程式、速率方程和吸放热情况如下:
反应I:2NO(g) N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) △H1<0
N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) △H1<0
反应II:N2O2(g)+O2(g) 2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) △H2<0
2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) △H2<0
反应2NO(g)+O2(g) 2NO2(g)的△H=
2NO2(g)的△H=_________ (用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)  2NO2(g)达到平衡状态,平衡常数的表达式K=
2NO2(g)达到平衡状态,平衡常数的表达式K=_________ (用k1正、k1逆、k2正、k2逆表示)。若升高温度,K将_________ (填“增大”、“减小”或“不变”)
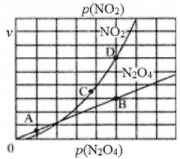
(3)反应N2O4(g) 2NO2(g),在一定条作下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p(NO2)其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是
2NO2(g),在一定条作下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p(NO2)其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_________ ,理由是__________________ 。
(4)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g) NO2(g)的速率却随着温度的升高而减小。已知反应Ⅱ速率较慢,且决定总反应速率是反应II,则反应I的活化能E1与反应II的活化能E2的大小关系为E1
NO2(g)的速率却随着温度的升高而减小。已知反应Ⅱ速率较慢,且决定总反应速率是反应II,则反应I的活化能E1与反应II的活化能E2的大小关系为E1_________ E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度反应Ⅱ速率减小的原因是_________ 。
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(1)将NO2和水蒸气混合,反应的现象为
(2)2NO(g)+O2(g)
 2NO2(g)的历程分两步,反应方程式、速率方程和吸放热情况如下:
2NO2(g)的历程分两步,反应方程式、速率方程和吸放热情况如下:反应I:2NO(g)
 N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) △H1<0
N2O2(g) (快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) △H1<0反应II:N2O2(g)+O2(g)
 2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) △H2<0
2NO2(g) (慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) △H2<0反应2NO(g)+O2(g)
 2NO2(g)的△H=
2NO2(g)的△H= 2NO2(g)达到平衡状态,平衡常数的表达式K=
2NO2(g)达到平衡状态,平衡常数的表达式K=(3)反应N2O4(g)
 2NO2(g),在一定条作下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p(NO2)其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是
2NO2(g),在一定条作下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p(NO2)其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是
(4)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)
 NO2(g)的速率却随着温度的升高而减小。已知反应Ⅱ速率较慢,且决定总反应速率是反应II,则反应I的活化能E1与反应II的活化能E2的大小关系为E1
NO2(g)的速率却随着温度的升高而减小。已知反应Ⅱ速率较慢,且决定总反应速率是反应II,则反应I的活化能E1与反应II的活化能E2的大小关系为E1A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
18-19高三上·四川南充·阶段练习
类题推荐
NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________ ,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________ (已知 )
)
(2)2NO(g)+O2(g) 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应2NO(g)+O2(g)  2NO2(g)的△H
2NO2(g)的△H______ (用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,若升高温度,K将
2NO2(g)达到平衡状态,若升高温度,K将____ (填“增大”、“减小”或“不变”),平衡常数的表达式K=____ (用 、
、 、
、 、
、 表示)
表示)
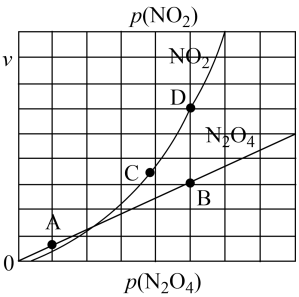
(3)反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中 、
、 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
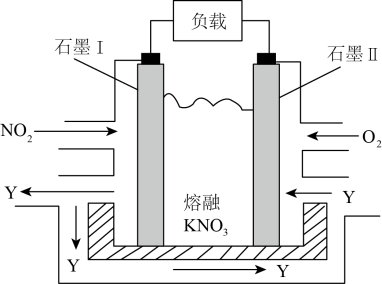
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式
(2)2NO(g)+O2(g)
 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:| 反应 | 速率表达式 | 反应热 |
反应I:2NO(g)  N2O2(g)(快) N2O2(g)(快) |  | △H1<0 |
反应II:N2O2(g)+O2(g)  2NO2(g)(慢) 2NO2(g)(慢) | 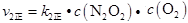 , , | △H2<0 |
 2NO2(g)的△H
2NO2(g)的△H 2NO2(g)达到平衡状态,若升高温度,K将
2NO2(g)达到平衡状态,若升高温度,K将(3)反应N2O4(g)
 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
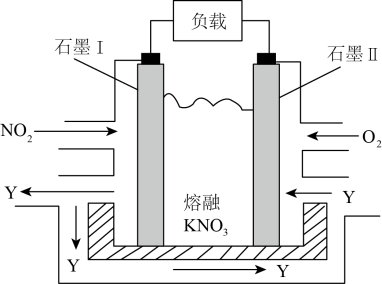
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



