解答题-原理综合题 适中0.65 引用1 组卷134
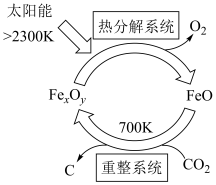
(1)科学家提出可通过铁的氧化物由CO2制取C,其太阳能工艺如图所示。
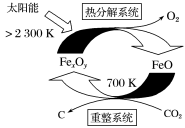
①“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为________ 。
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为________ 。
(2)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则以CO2和H2反应合成甲醚的热化学方程式为_________________ 。
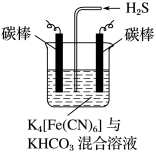
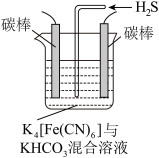
(3)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S===2[Fe(CN)6]4-+2HCO3-+S↓。电解时,阳极的电极反应式为_______________ ;电解过程中阴极区溶液的pH________ (填“变大”、“变小”或“不变”)。

①“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为
(2)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则以CO2和H2反应合成甲醚的热化学方程式为
(3)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S===2[Fe(CN)6]4-+2HCO3-+S↓。电解时,阳极的电极反应式为

18-19高三上·河北衡水·期中
类题推荐
低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。结合下列有关图示和所学知识回答:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)
 C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=
C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=____ kJ•mol-1(用含a、b的式子表示)。又知:相关化学键的键能如表所示,实验测得上述反应的△H=-152kJ•mol-1,则表中的x=____ 。

注:乙烯结构如图:
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为____ 。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由CO2制取C的太阳能工艺如图所示。

已知“重整系统”发生的反应中 =6,则FexOy的化学式为
=6,则FexOy的化学式为____ 。“热分解系统”中每分解1molFexOy,转移电子的物质的量为____ mol。
②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) △H1=+23.4kJ•mol-1,则2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) △H3____ kJ•mol-1。
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)

| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/kJ•mol-1 | 803 | 436 | x | 414 | 464 |
注:乙烯结构如图:

(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由CO2制取C的太阳能工艺如图所示。

已知“重整系统”发生的反应中
②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ•mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) △H1=+23.4kJ•mol-1,则2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) △H3
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CH3OCH3(g)+3H2O(g) △H3=
CH3OCH3(g)+3H2O(g) △H3=