解答题-实验探究题 适中0.65 引用1 组卷273
硫的化合物在生产、生活中应用广泛。
Ⅰ.某兴趣小组探究SO2气体还原Fe3+、I2。
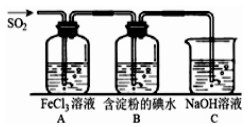
(1)写出A中反应的离子方程式:______________________________________ 。
(2)通入足量SO2后,装置B中的现象是_________________________________ ;
(3)装置C的作用是___________________________________________________ 。
Ⅱ.一些食品添加剂、抗氧化剂中含有焦亚硫酸钠(Na2S2O5),大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:Na2S2O5溶于水会生成NaHSO3。检验Na2S2O5晶体在空气中已被氧化的实验方法是_______________________________________ 。
III. 实验室需要1.0mol·L-1硫酸溶液480 mL,根据溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________ (填字母),配制上述溶液还需用到的玻璃仪器是__________________________________________ (填仪器名称)。

(2)应该用量筒量取_______ mL质量分数为98%、密度为1.84 g·cm-3的浓硫酸。
(3)在配制上述溶液的实验中,下列操作引起结果偏高的有_______ (填字母序号)。
A.若容量瓶用蒸馏水洗涤后未干燥
B.若定容时,俯视液面加水至刻度线
C.若用量筒量取浓硫酸时,俯视读数
D.若浓硫酸稀释后未冷却,立即转移到容量瓶中并定容
Ⅰ.某兴趣小组探究SO2气体还原Fe3+、I2。

(1)写出A中反应的离子方程式:
(2)通入足量SO2后,装置B中的现象是
(3)装置C的作用是
Ⅱ.一些食品添加剂、抗氧化剂中含有焦亚硫酸钠(Na2S2O5),大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:Na2S2O5溶于水会生成NaHSO3。检验Na2S2O5晶体在空气中已被氧化的实验方法是
III. 实验室需要1.0mol·L-1硫酸溶液480 mL,根据溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是

(2)应该用量筒量取
(3)在配制上述溶液的实验中,下列操作引起结果偏高的有
A.若容量瓶用蒸馏水洗涤后未干燥
B.若定容时,俯视液面加水至刻度线
C.若用量筒量取浓硫酸时,俯视读数
D.若浓硫酸稀释后未冷却,立即转移到容量瓶中并定容
2018·甘肃平凉·三模
知识点:物质的量浓度计算-溶液配制有关计算二氧化硫的弱氧化性配制一定物质的量浓度的溶液的步骤、操作配制一定物质的量浓度的溶液实验的仪器 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
(Ⅰ)实验室需要1.0mol·L-1硫酸溶液80mL,根据溶液的配制情况回答下列问题:
(1)配制上述溶液,除了烧杯、玻璃棒、胶头滴管、量筒外,还需用到的玻璃仪器是_____ 。
(2)应该用量筒量取_____ mL质量分数为98%、密度为1.84g·cm-3的浓硫酸。
(3)在配制上述溶液的实验中,下列操作引起结果偏高的有_____ (填字母序号)。
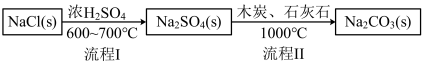
(Ⅱ)碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
世界上最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如图:

(4)流程I的另一产物是_____ ,流程Ⅱ的反应分步进行:a.Na2SO4+4C=Na2S+4CO↑;b.Na2S与石灰石发生复分解反应,流程Ⅱ的总反应方程式可表示为_____ 。
(1)配制上述溶液,除了烧杯、玻璃棒、胶头滴管、量筒外,还需用到的玻璃仪器是
(2)应该用量筒量取
(3)在配制上述溶液的实验中,下列操作引起结果偏高的有
| A.若容量瓶用蒸馏水洗涤后未干燥 |
| B.若定容时,俯视液面加水至刻度线 |
| C.若用量筒量取浓硫酸时,俯视读数 |
| D.若浓硫酸稀释后未冷却,立即转移到容量瓶中并定容 |
(Ⅱ)碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
世界上最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如图:

(4)流程I的另一产物是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网