解答题-原理综合题 适中0.65 引用3 组卷653
铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________ ,占据最高能级的电子的电子云轮廓图形状为___________ ,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________ 。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________ 。
(3)AlF3具有较高的熔点(1040℃),属于___________ 晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________ 。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________ ,该阴离子中存在的化学键有___________ (填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
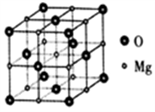
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________ 。立方体边长为acm,阿伏伽德罗常数的值为NA,则CaF2晶体的密度为___________ g·cm-3(列出计算式)
(1)基态铝原子的核外电子排布式为
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式
(3)AlF3具有较高的熔点(1040℃),属于
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为

2018·四川·一模
类题推荐
铝和氟的化合物在制造、化工等领域都有广泛应用。
(1)写出基态F原子的轨道表示式___________ 。
(2)OF2分子的空间构型为___________
(3)六氟铝酸铵[(NH4)3AlF6] 热分解可以制备AlF3。
①[(NH4)3AlF6]中电负性最大的是_______ ,请判断基态铝原子与基态镁原子第一电离能的大小并分析其原因是________ 。
②AlF3具有较高的熔点(1040℃),属于_______ (填晶体类型)晶体;AlCl3在178℃时升华,写出AlF3、AlCl3晶体类型不同的原因________ (从原子结构与元素性质的角度作答)。
(4)NaAlO2在水溶液中实际上是以Na[Al(OH)4]的形式存在,其中[Al(OH)4]-为配离子,Al原子的杂化方式为______ ,该阴离子中存在的化学键有______ 。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
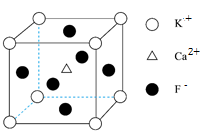
(5)某含氟立方卤化物可用于制作光电材料,其晶胞结构如图所示,下列说法错误的是______。
(1)写出基态F原子的轨道表示式
(2)OF2分子的空间构型为___________
| A.直线形 | B.折线形 | C.三角锥形 | D.四面体形 |
①[(NH4)3AlF6]中电负性最大的是
②AlF3具有较高的熔点(1040℃),属于
(4)NaAlO2在水溶液中实际上是以Na[Al(OH)4]的形式存在,其中[Al(OH)4]-为配离子,Al原子的杂化方式为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)某含氟立方卤化物可用于制作光电材料,其晶胞结构如图所示,下列说法错误的是______。

| A.K+的配位数为12 | B.该物质的化学式为KCaF3 |
| C.与F-距离最近的是K+ | D.将F-换为Cl-,则晶胞棱长将增大 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网