解答题-原理综合题 较难0.4 引用2 组卷165
以氢为原料的工业生产工艺及氢的获得是科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ·mol-1、-285.8kJ·mol-1。由H2和CO生成甲醇的热化学方程式为:2H2(g)+CO(g)= CH3OH(1)的△H=-91kJ·mol-1。则3H2(g)+CO2(g)=CH3OH(1)+H2O(1)的△H=____________ kJ·mol-1。
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率如图甲所示。
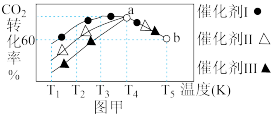
该反应在a点达到平衡状态,a点转化率比b点的高,其原因是____________ 。
(2)利用CO和H2O生产H2:CO(g)+H2O(g) ⇌ CO2(g)+H2(g)。将不同配比的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中。有关数据如下表:
①该反应的正反应为________ 反应(填“吸热”、“放热”)。
②650℃时,下列叙述说明达到化学平衡状态的是_____ (填标号)
a.v(CO):v(H2O):v(H2):v(CO2)=1:1:1:1
b.生成n mol CO2(g)的同时生成n mol H2O(g)
c.n mol CO断裂的同时断裂2n mol H—H
d.某时刻,n(CO):n(H2O):n(CO2):n(H2)=6:1:4:4
③900℃时,达平衡时v(H2O)=_______ mol·L-1·min-1。(结果保留两位有效数字)
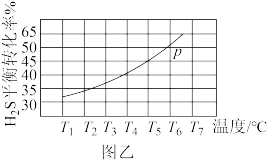
(3)利用工业废气中的H2S热分解制H2:2H2S(g) ⇌ 2H2(g)+S2(g)。现将0.2molH2S(g)通入某恒压密闭容器中,起始压强p0=aMPa,在不同温度下测得H2S的平衡转化率如图乙所示,则T6℃时,该反应的Kp=________ (用含a的代数式表示)。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ·mol-1、-285.8kJ·mol-1。由H2和CO生成甲醇的热化学方程式为:2H2(g)+CO(g)= CH3OH(1)的△H=-91kJ·mol-1。则3H2(g)+CO2(g)=CH3OH(1)+H2O(1)的△H=
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率如图甲所示。

该反应在a点达到平衡状态,a点转化率比b点的高,其原因是
(2)利用CO和H2O生产H2:CO(g)+H2O(g) ⇌ CO2(g)+H2(g)。将不同配比的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中。有关数据如下表:
| 温度/ | 起始量 | 平衡数据 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 | 33.3% | 3 | |
①该反应的正反应为
②650℃时,下列叙述说明达到化学平衡状态的是
a.v(CO):v(H2O):v(H2):v(CO2)=1:1:1:1
b.生成n mol CO2(g)的同时生成n mol H2O(g)
c.n mol CO断裂的同时断裂2n mol H—H
d.某时刻,n(CO):n(H2O):n(CO2):n(H2)=6:1:4:4
③900℃时,达平衡时v(H2O)=
(3)利用工业废气中的H2S热分解制H2:2H2S(g) ⇌ 2H2(g)+S2(g)。现将0.2molH2S(g)通入某恒压密闭容器中,起始压强p0=aMPa,在不同温度下测得H2S的平衡转化率如图乙所示,则T6℃时,该反应的Kp=

18-19高三上·山东日照·期中
类题推荐
氢是人们公认的清洁能源,作为低碳和零碳能源正在脱颖而出,氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ·mol-1、-285.8 kJ·mol-1。CO与H2合成甲醇的能量变化如图甲所示:
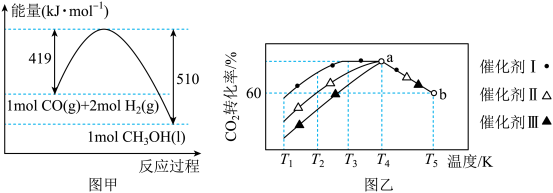
则用CO2和H2(g)制备甲醇和液态水的热化学方程式为_______________________ 。
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示;催化效果最好的是催化剂_____ (选填“Ⅰ”、“Ⅱ”或“Ⅲ”);该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是________ 。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g) CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到数据如下表所示:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到数据如下表所示:
①该反应的正反应为___________ 反应(选填“放热”或“吸热” )。
②900℃时,从开始到达到平衡时的反应速率υ(H2O)=__________ ,达到平衡时c(H2)=_______ (保留2位小数)。
(3)利用废弃的H2S的热分解可生产H2:2H2S(g) 2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如图所示。已知:对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数。温度为T4℃时,该反应的平衡常数Kp=
2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如图所示。已知:对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数。温度为T4℃时,该反应的平衡常数Kp=_________ (用a的代数式表示)。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ·mol-1、-285.8 kJ·mol-1。CO与H2合成甲醇的能量变化如图甲所示:

则用CO2和H2(g)制备甲醇和液态水的热化学方程式为
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示;催化效果最好的是催化剂
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)
 CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到数据如下表所示:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到数据如下表所示:| 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 | 1/3 | 3 | |
①该反应的正反应为
②900℃时,从开始到达到平衡时的反应速率υ(H2O)=
(3)利用废弃的H2S的热分解可生产H2:2H2S(g)
 2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如图所示。已知:对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数。温度为T4℃时,该反应的平衡常数Kp=
2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如图所示。已知:对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数。温度为T4℃时,该反应的平衡常数Kp=
氢是人们公认的清洁能源,作为低碳和零碳能源正在脱颖而出,氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知 CO(g)和H2(g)的燃烧热(ΔH)分别为-283.0 kJ·mol -1、-285.8 kJ·mol -1。CO与H2合成甲醇的能量变化如图甲所示。则用 CO2和H2(g)制备甲醇的热化学方程式为_____ 。

②将一定量的 CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:
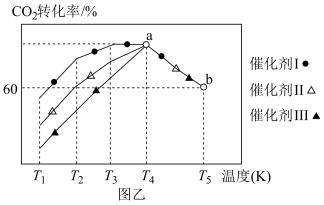
催化效果最好的是催化剂____________ (选填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是_____________ 。
(2) 利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g) CO2(g)+H2(g)。将不同量的 CO(g)和H2O(g)分别通入到体积为2 L 的恒容密闭容器中进行反应,得到三组数据如下表所示:
CO2(g)+H2(g)。将不同量的 CO(g)和H2O(g)分别通入到体积为2 L 的恒容密闭容器中进行反应,得到三组数据如下表所示:
①该反应的ΔH_______ 0(选填“>”或“<”)。
②900℃时,达到平衡时c(CO)=_______ ,达到平衡时的反应速率v(H2O)=____ (保留2位小数)。
(3) 利用废弃的H2S的热分解可生产H2:
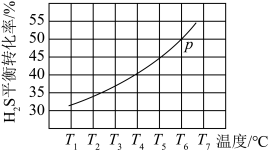
2H2S(g) 2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强 p=aMPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强 p=aMPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:

已知:对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可表示平衡常数。温度为T 6℃时,该反应的平衡常数Kp =_______ (用a的代数式表示)。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知 CO(g)和H2(g)的燃烧热(ΔH)分别为-283.0 kJ·mol -1、-285.8 kJ·mol -1。CO与H2合成甲醇的能量变化如图甲所示。则用 CO2和H2(g)制备甲醇的热化学方程式为

②将一定量的 CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:

催化效果最好的是催化剂
(2) 利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)
| 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 | 3 | ||
②900℃时,达到平衡时c(CO)=
(3) 利用废弃的H2S的热分解可生产H2:
2H2S(g)

已知:对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可表示平衡常数。温度为T 6℃时,该反应的平衡常数Kp =
Ⅰ.以氢为原料的工业生产工艺及氢的获得是科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。已知CO(g)和H2(g)的燃烧热(ΔH)分别为–283.0 kJ/mol、–285.8 kJ/mol。由H2和CO生成甲醇的热化学方程式为:2H2(g)+CO(g)=CH3OH(1)的ΔH=–91 kJ/mol。则3H2(g)+CO2(g)=CH3OH(1)+H2O(1)的ΔH=_______ kJ/mol。
(2)利用CO和H2O生产H2:CO(g)+H2O(g)⇌CO2(g)+H2(g)。将不同配比的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中。有关数据如下表:
①该反应的正反应为_______ 反应(填“吸热”、“放热”)。
②650℃时,下列叙述说明达到化学平衡状态的是_______ (填标号)。
A.v(CO):v(H2O):v(H2):v(CO2)=1:1:1:1
B.生成n mol CO2(g)的同时生成n mol H2O(g)
C.断裂n molCO化学键的同时断裂2n mol H2化学键
D.某时刻,n(CO):n(H2O):n(CO2):n(H2)=6:1:4:4
(3)利用工业废气中的H2S热分解制H2:2H2S(g)⇌2H2(g)+S2(g)。现将0.2 mol H2S(g)通入某恒压密闭容器中,起始压强P0=a MPa,在不同温度下测得H2S的平衡转化率如下图所示,则T6℃时,该反应的Kp=_______ (用含a的代数式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

Ⅱ.弱电解质在水溶液中存在多种平衡,它们在工农业生产中都有广泛的应用。
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(4)物质的量浓度均为0.1 mol·L−1的下列四种溶液:pH由小到大 排列的顺序_______ 。(填序号)
①CH3COONa ②Na2CO3 ③NaClO ④NaHCO3
(5)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_______ 。
(6)25℃时,将a mol·L−1的醋酸溶液与b mol·L−1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=_______ (用含a、b的代数式表示)。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。已知CO(g)和H2(g)的燃烧热(ΔH)分别为–283.0 kJ/mol、–285.8 kJ/mol。由H2和CO生成甲醇的热化学方程式为:2H2(g)+CO(g)=CH3OH(1)的ΔH=–91 kJ/mol。则3H2(g)+CO2(g)=CH3OH(1)+H2O(1)的ΔH=
(2)利用CO和H2O生产H2:CO(g)+H2O(g)⇌CO2(g)+H2(g)。将不同配比的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中。有关数据如下表:
| 温度/℃ | 起始量 | 平衡数据 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 3 | 33.3% | 3 | |
②650℃时,下列叙述说明达到化学平衡状态的是
A.v(CO):v(H2O):v(H2):v(CO2)=1:1:1:1
B.生成n mol CO2(g)的同时生成n mol H2O(g)
C.断裂n molCO化学键的同时断裂2n mol H2化学键
D.某时刻,n(CO):n(H2O):n(CO2):n(H2)=6:1:4:4
(3)利用工业废气中的H2S热分解制H2:2H2S(g)⇌2H2(g)+S2(g)。现将0.2 mol H2S(g)通入某恒压密闭容器中,起始压强P0=a MPa,在不同温度下测得H2S的平衡转化率如下图所示,则T6℃时,该反应的Kp=

Ⅱ.弱电解质在水溶液中存在多种平衡,它们在工农业生产中都有广泛的应用。
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.810−5 | Ka1=4.310−7、Ka2=5.610−11 | Ka=3.010−8 |
(4)物质的量浓度均为0.1 mol·L−1的下列四种溶液:pH
①CH3COONa ②Na2CO3 ③NaClO ④NaHCO3
(5)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(6)25℃时,将a mol·L−1的醋酸溶液与b mol·L−1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数Ka=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


