填空题 适中0.65 引用2 组卷599
(1)Ⅰ.工业上利用
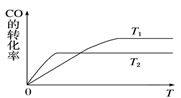
温度升高,该化学平衡移动后达到新的平衡,
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应
(2)图中
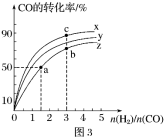
(3)比较a、b、c三点所处的平衡状态中,反应物
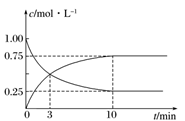
(4)若容器体积为
17-18高二·全国·单元测试
类题推荐
工业上用N2和H2合成NH3 “N2(g) + 3H2(g) 2NH3(g) ∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ∆H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g) + O2(g) =2NO(g) ∆H1=" +a" kJ·mol-1
N2(g) + 3H2(g) 2NH3(g) ∆H2=-b kJ·mol-1
2NH3(g) ∆H2=-b kJ·mol-1
2H2(g) + O2(g) =2H2O(g) ∆H3=-c kJ·mol-1
若有34 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_____ 。
(2)合成NH3达到平衡后,某时刻改变下列条件____ ,在达到新平衡的过程中正反应速率始终增大。
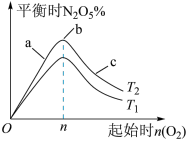
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
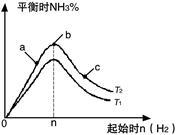
①图象中T2和T1的关系是:T2______ T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最大的是___ (填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度
为_____ mol·L-1。
(4)一定温度下,将2molN2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
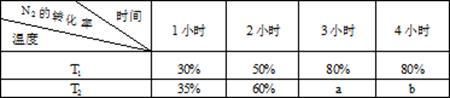
上表中a、b、80%三者的大小关系为_____ (填“>”、“=”、“<”、“无法比较”)。
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在下图中画出平衡常数K随时间的变化曲线______ 。

(1)已知:N2(g) + O2(g) =2NO(g) ∆H1=" +a" kJ·mol-1
N2(g) + 3H2(g)
2H2(g) + O2(g) =2H2O(g) ∆H3=-c kJ·mol-1
若有34 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
(2)合成NH3达到平衡后,某时刻改变下列条件
| A.升温 | B.加压 | C.增大c(N2) | D.降低c(NH3) |
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)

①图象中T2和T1的关系是:T2
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最大的是
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度
为
(4)一定温度下,将2molN2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:

上表中a、b、80%三者的大小关系为
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在下图中画出平衡常数K随时间的变化曲线

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2NH3(g)
2NH3(g)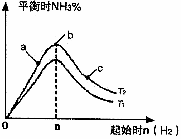
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)