解答题-实验探究题 较难0.4 引用1 组卷257
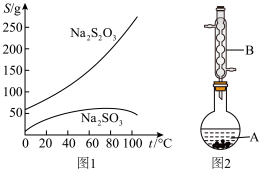
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
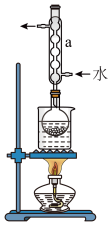
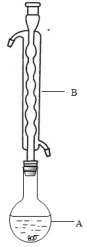
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
④滤液在经过______________ 、_____________ 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________ ,其作用是____________________ ,加入的硫粉用乙醇润湿的目的是____________________________ 。
(2)步骤④应采取的操作是_________________ 、________________ 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________ 。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________ 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________ (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
则所得产品的纯度为______________________________ ,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________ 。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。

④滤液在经过
⑤进行减压过滤并干燥。
(1)仪器B的名称是
(2)步骤④应采取的操作是
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 第一次 | 0.30 | 30.52 |
| 第二次 | 0.36 | 31.06 |
| 第三次 | 1.10 | 31.28 |
则所得产品的纯度为
18-19高三上·黑龙江哈尔滨·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网