填空题 较难0.4 引用3 组卷428
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____ (填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____ 。
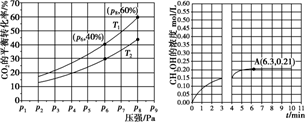
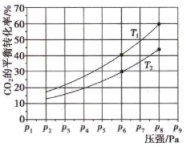
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较 T1与 T2 的大小关系:T1_____ T2 (填“ < ”、“= ”或“> ”) ,理由是:_____ 。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____ 。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____ ,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____ (保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____ L。
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1反应Ⅱ:CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2反应Ⅲ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1回答下列问题:
(1)反应Ⅲ的 ΔS

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较 T1与 T2 的大小关系:T1
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为
18-19高二上·四川成都·期中
类题推荐
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;
②CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C O”表示CO的化学键)计算X=
O”表示CO的化学键)计算X=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为___________ 。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______________ 。(提示:从对反应速率、平衡状态、转化率角度回答)
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)△H=-99kJ•mol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJ•mol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
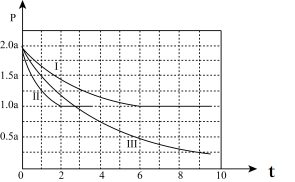
①Ⅱ和Ⅰ相比,改变的反应条件是_________ ;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_____ ;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________ ;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____ T3(填“>”“<”“=”)
①CO2(g)+3H2(g)
②CO(g)+2H2(g)
③CO2(g)+H2(g)
| 化学键 | H-H | C-O | C | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为
(3)根据化学反应原理,分析增大压强对反应③的影响为
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)

①Ⅱ和Ⅰ相比,改变的反应条件是
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网